题目内容
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
(1)配合物Ni(CO)4常温为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于 晶体;基态Ni原子的电子排布式为 .
(2)配合物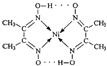 分子内的作用力除共价键外,还存在的两种作用力是 (填
分子内的作用力除共价键外,还存在的两种作用力是 (填
编号).
A.氢键 B.离子键 C. 范德华力 D.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应.
如:①CH2=CH2、②CH≡CH、③ 、④HCHO等,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形.
、④HCHO等,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形.
(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据如下表.

据此分析Mn2+比Fe2+ (填“更易”或“更难”)再失去-个电子,从微粒结构的角度简述其原因是 .
(1)配合物Ni(CO)4常温为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于
(2)配合物
 分子内的作用力除共价键外,还存在的两种作用力是
分子内的作用力除共价键外,还存在的两种作用力是编号).
A.氢键 B.离子键 C. 范德华力 D.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应.
如:①CH2=CH2、②CH≡CH、③
 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据如下表.

据此分析Mn2+比Fe2+
考点:配合物的成键情况,化学键,判断简单分子或离子的构型
专题:化学键与晶体结构
分析:(1)根据合物Ni(CO)4的性质熔点、溶解性判断;Ni元素是28号元素,根据核外电子排布规律书写基态原子的电子排布式;
(2)根据图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间为氢键;
(3)根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数;根据杂化轨道方式及杂化轨道成键情况判断HCHO立体结构;
(4)电离能越大,越不容易失去电子.根据第三电离能可知Mn2+再失去电子比Fe2+更难.电子处于半满、全满、全空是更稳定.
(2)根据图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间为氢键;
(3)根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数;根据杂化轨道方式及杂化轨道成键情况判断HCHO立体结构;
(4)电离能越大,越不容易失去电子.根据第三电离能可知Mn2+再失去电子比Fe2+更难.电子处于半满、全满、全空是更稳定.
解答:
解:(1)配合物Ni(CO)4常温为液态,熔点低,易溶于CCl4、苯等有机溶剂,所以Ni(CO)4属于分子晶体;
Ni元素是28号元素,位于第四周期第Ⅷ族,其基态原子的电子排布式1s22s22p63s23p63d84s2;
故答案为:分子;1s22s22p63s23p63d84s2;
(2)根据图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间为氢键.
故选:AD;
(3)①CH2=CH2中碳原子成2个C-Hδ键,1个碳碳双键,双键中含有1个δ键、1个π键,杂化轨道数为2+1=3,所以碳原子采取sp2杂化;
②CH≡CH中碳原子成2个C-Hδ键,1个碳碳三键,三键中含有1个δ键、2个π键,杂化轨道数为1+1=2,所以碳原子采取sp杂化;
③苯中碳原子成1个C-Hδ键,2个C-Cδ键,同时参与成大π键,杂化轨道数为1+2=3,所以碳原子采取sp2杂化;
④HCHO中碳原子成2个C-Hδ键,1个碳氧双键,双键中含有1个δ键、1个π键,杂化轨道数为2+1=3,所以碳原子采取sp2杂化;
故①、③、④采取sp2杂化.
HCHO中碳原子采取sp2杂化,杂化轨道为平面正三角形,未容纳孤对电子对,全部成δ键,参与成键的原子不同,所以HCHO为平面三角形.
故答案为:①、③、④;平面三角形;
(4)Mn的I3=3248kJ?mo1-1大于Fe的I3=2957kJ?mo1-1,所以Mn2+再失去电子比Fe2+更难,原因是Mn2+(3d5)属于较稳定的半充满结构.
故答案为:更难;Mn2+(3d5)属于较稳定的半充满结构.
Ni元素是28号元素,位于第四周期第Ⅷ族,其基态原子的电子排布式1s22s22p63s23p63d84s2;
故答案为:分子;1s22s22p63s23p63d84s2;
(2)根据图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间为氢键.
故选:AD;
(3)①CH2=CH2中碳原子成2个C-Hδ键,1个碳碳双键,双键中含有1个δ键、1个π键,杂化轨道数为2+1=3,所以碳原子采取sp2杂化;
②CH≡CH中碳原子成2个C-Hδ键,1个碳碳三键,三键中含有1个δ键、2个π键,杂化轨道数为1+1=2,所以碳原子采取sp杂化;
③苯中碳原子成1个C-Hδ键,2个C-Cδ键,同时参与成大π键,杂化轨道数为1+2=3,所以碳原子采取sp2杂化;
④HCHO中碳原子成2个C-Hδ键,1个碳氧双键,双键中含有1个δ键、1个π键,杂化轨道数为2+1=3,所以碳原子采取sp2杂化;
故①、③、④采取sp2杂化.
HCHO中碳原子采取sp2杂化,杂化轨道为平面正三角形,未容纳孤对电子对,全部成δ键,参与成键的原子不同,所以HCHO为平面三角形.
故答案为:①、③、④;平面三角形;
(4)Mn的I3=3248kJ?mo1-1大于Fe的I3=2957kJ?mo1-1,所以Mn2+再失去电子比Fe2+更难,原因是Mn2+(3d5)属于较稳定的半充满结构.
故答案为:更难;Mn2+(3d5)属于较稳定的半充满结构.
点评:本题综合性较大,涉及晶体、化学键、杂化轨道、电子排布式等,旨在考查学生对知识的掌握与利用,难度中等.

练习册系列答案
相关题目
某学习小组设计如下实验方案,相关推测不合理的是( )
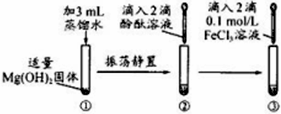

| A、试管②滴入酚酞后溶液可能变浅红 |
| B、试管③滴入FeCl3溶液后有红褐色沉淀生成 |
| C、试管③中的变化是物理变化 |
| D、上述反应说明Fe(OH)3溶解性小于Mg(OH)2 |
下列方程式中,正确的是( )
| A、将铜屑加入含Fe3+溶液中的离子反应方程式:Fe3++Cu═Fe2++Cu2+ |
| B、硫酸氢钠在水中的电离方程式:NaHSO4═Na++H++SO42- |
| C、Ba(OH)2溶液与稀H2SO4反应的离子方程式:Ba2++SO42-═BaSO4↓ |
| D、Cu和浓硫酸反应的离子方程式:Cu+2H+═Cu2++H2↑ |
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是 ( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 澄清石灰水 |
| ② | HCl | CO2 | Ba(OH)2 |
| ③ | CO2 | SO2 | Ba(NO3)2 |
| ④ | NO2 | SO2 | BaCl2 |
| ⑤ | CO2 | NH3 | CaCl2 |
| A、①②③④ | B、①②③④⑤ |
| C、②③④ | D、①③④ |
下列关于物质的用途,不正确的是( )
| A、小苏打可用于治疗胃酸过多 |
| B、Cl2可与石灰乳反应制取漂白粉 |
| C、镁铝合金可用作制造飞机的材料 |
| D、铁制容器不能用于贮存浓硫酸 |
下列气体:①Cl2 ②SO2 ③NH3 ④H2S ⑤H2 不能用浓硫酸干燥的是( )
| A、只有③ | B、③④ |
| C、②③④⑤ | D、全部 |
下列物质的电子式中,书写错误的是( )
A、氮气 |
B、氨气 |
C、氯化氢 |
D、氯化钠 |
1mol乙烯与氯气完全加成后再与氯气取代,整个过程最多需氯气( )
| A、1mol | B、4mol |
| C、5mol | D、6mol |