题目内容
13.将98%(物质的量浓度为18.4mol•L-1)10mL的浓硫酸与等体积的水混合,冷却到室温,下列关于所得溶液的说法正确的是( )| A. | 溶质物质的量浓度大于9.2mol/L | B. | 溶液体积为20mL | ||
| C. | 溶质质量分数为49% | D. | 溶质质量分数小于49% |
分析 A.硫酸与水的密度不同,水分子与硫酸分子间有间隙,等体积混合,混合所得溶液的总体积小于硫酸体积的二倍;
B.硫酸与水的密度不同,混合所得溶液的总体积不等于硫酸体积的二倍;
C.水的密度比硫酸的密度小,等体积混合时,硫酸的质量大于水的质量,总质量小于原硫酸溶液的2倍;
D.溶质质量分数大于49%.
解答 解:A.硫酸与等体积水混合后,所得溶液中硫酸的物质的量不变,则稀释前后,硫酸的物质的量不变,C1V1=C2V2,所以C2=$\frac{{C}_{1}{V}_{1}}{{V}_{2}}$=$\frac{18.4{V}_{1}}{{V}_{2}}$,但是V2<2V1,所以所得溶液的物质的量浓度大于9.2mol/L,故A正确;
B.硫酸与水的密度不同,水分子与硫酸分子间有间隙,等体积混合,溶液体积小于20mL,故B错误;
C.水的密度比硫酸的密度小,等体积混合时,硫酸的质量大于水的质量,总质量小于原硫酸溶液的2倍,所以该硫酸与等体积的水混合所得溶液的质量分数大于49%,故C错误;
D.根据C分析可知,溶质质量分数大于49%,故D错误;
故选A.
点评 本题考查溶液浓度有关计算,题目难度中等,注意C选项为易错点,等体积混合时,硫酸的质量大于水的质量,总质量小于原硫酸溶液的2倍.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
20.有一未完成的离子方程式:_+XO3-+6H+═3X2+3H2O,据此判断,下面对短周期元素X的判断正确的是( )
| A. | XO3-中X为+5价,故X元素位于第VA族 | |
| B. | X位于第二周期第VIIA族 | |
| C. | X可能是氯元素 | |
| D. | X可能是氮元素 |
4.下列叙述正确的是( )
| A. | 在同温同压下,相同体积的任何气体所含的原子数相同 | |
| B. | 相同条件下,N2和O2的混合气体与等体积的N2所含原子数相等 | |
| C. | 等物质的量的NH4+和OH-所含质子数相等且电子数也相等 | |
| D. | 1mol 乙基中含有的电子数为18NA |
8.下列有关叙述正确的是( )
| A. | 常温常压下,11.2LCO2与8.5gNH3所含分子数相等 | |
| B. | 等物质的量的H3O+和OH-质子数之比与电子数之比相同 | |
| C. | 常温常压下,48gO3和O2的混合气体中含有的氧原子数为3NA | |
| D. | 标准状况下,22.4LH2和Cl2的混合气体中含有的分子数为2NA |
18.下列溶液中物质的量浓度为1mol•L-1的是( )
| A. | 将40g NaOH溶解于1L水中 | |
| B. | 10g NaOH溶解在水中配成250mL溶液 | |
| C. | 从100mL 10mol•L-1的浓盐酸中取出10mL | |
| D. | 将22.4L氯化氢气体溶于水配成1L溶液 |
5.下列叙述中,正确的是( )
| A. | 由同种元素组成的物质一定属于纯净物 | |
| B. | NaHCO3在水中电离:NaHCO3═Na++H++CO32- | |
| C. | 含金属元素的离子不一定都是阳离子 | |
| D. | 具有相同质子数的微粒都属于同种元素 |
2.不能用胶体知识解释的是( )
| A. | 静电除尘 | |
| B. | 一支钢笔用不同牌子的两种墨水,易堵塞 | |
| C. | 氯化铁溶液加入碳酸钠溶液出现红褐色沉淀 | |
| D. | 河水和海水交界处形成三角洲 |

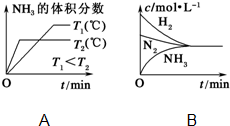 已知工业上合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,回答以下问题:
已知工业上合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,回答以下问题: