题目内容
100ml 6mol/L H2SO4与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A、Na2SO4(s) |
| B、NaOH |
| C、(NH4)2SO4(s)? |
| D、K2SO4溶液 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:过量的锌粉反应,硫酸完全反应,为了减缓反应速率但又不影响生成氢气的总量,可减小氢离子浓度但不改变其物质的量,以此来解答.
解答:
解:A.加硫酸钠固体,对反应速率无影响,故A不选;
B.烧碱与硫酸反应,减少生成氢气的量,故B不选;
C.加(NH4)2SO4(s),对反应速率无影响,故C不选;
D.加硫酸钾溶液,氢离子浓度减小,但氢离子物质的量不变,则减缓反应进行的速率,但又不影响生成氢气的总量,故D选;
故选D.
B.烧碱与硫酸反应,减少生成氢气的量,故B不选;
C.加(NH4)2SO4(s),对反应速率无影响,故C不选;
D.加硫酸钾溶液,氢离子浓度减小,但氢离子物质的量不变,则减缓反应进行的速率,但又不影响生成氢气的总量,故D选;
故选D.
点评:本题考查影响化学反应速率的因素,注意信息中Zn过量及浓度对反应速率的影响即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
下列说法正确的是( )
| A、在任何条件下,纯水都呈中性 |
| B、pH<7的溶液一定呈酸性 |
| C、25℃时,纯水和稀酸溶液中水的离子积常数不相符 |
| D、pH均等于6的NH4Cl溶液和CH2COOH溶液中,水的电离程度相同 |
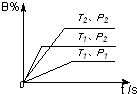 已知某可逆反应m A(g)+n B(气)?p C(气)+Q,在密闭容器中进行,右图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线.由曲线分析,下列判断正确的是( )
已知某可逆反应m A(g)+n B(气)?p C(气)+Q,在密闭容器中进行,右图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线.由曲线分析,下列判断正确的是( )| A、T1<T2,P1>P2,m+n>p,Q>0 |
| B、T1>T2,P1<P2,m+n>p,Q<0 |
| C、T1<T2,P1>P2,m+n<p,Q>0 |
| D、T1>T2,P1<P2,m+n<p,Q>0 |
今有一混合物的水溶液,只可能含有以下离子中的若干种(不考虑水的电离):K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:(1)第一份加入AgNO3溶液有沉淀产生;(2)第二份加足量NaOH溶液加热后,收集到标准状况下气体896ml(气体全部逸出);(3)第三份加足量BaCl2溶液后,得干燥沉淀6.3g,经足量盐酸洗涤、干燥后,沉淀质量4.66g.根据上述实验,以下推测正确的是( )
| A、K+一定存在 |
| B、100 mL溶液中含0.02 mol CO32- |
| C、Cl-一定存在 |
| D、Ba2+一定不存在,Mg2+可能存在 |
下列方程式书写正确的是( )
| A、HCO3-的电离方程式:HCO3-+H2O═H2CO3+OH- |
| B、NH3?H2O的电离方程式:NH3?H2O?NH4++OH- |
| C、CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- |
| D、NH4Cl的水解方程式:NH4++H2O═NH3?H2O+H+ |