题目内容
6.下列说法正确的是( )| A. | CO2属于大气污染物 | |
| B. | 酸雨是PH小于7的雨水 | |
| C. | 硅酸钠溶液应保存在带玻璃塞的试剂瓶中 | |
| D. | 大气中CO2含量的增加会导致温室效应加剧 |
分析 A.常见的空气污染物:二氧化硫、一氧化碳、二氧化氮、可吸入颗粒及臭氧等;
B.正常雨水因溶有空气中的二氧化碳(生成碳酸)而略显酸性,其pH小于7;
C.硅酸钠是无机矿物胶,具有粘合性,使瓶塞与试剂瓶粘在一起;
D.大气中CO2含量的增加会导致温室效应加剧.
解答 解:A.CO2不属于大气污染物,故A错误;
B.雨水因溶有空气中的二氧化碳(生成碳酸)而略显酸性属于正常雨水;人们通常把pH小于5.6的降水成为酸雨,故B错误;
C.硅酸钠是无机矿物胶,具有粘合性,使瓶塞与试剂瓶粘在一起,应使用橡胶塞,故C错误;
D.大气中CO2含量的增加会加剧温室效应,注意节能减排,故D正确.
故选D.
点评 本题考查环境污染及物质的性质,明确空气污染物、酸雨、温室效应的判断即可解答,题目难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
16.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:
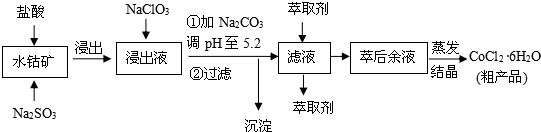
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH表:(金属离子浓度为:0,01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH表:(金属离子浓度为:0,01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
14.下列溶液中有关物质的量浓度关系正确的是( )
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)═c(H+)+c(CH3COOH) | |
| D. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
1.下列盛放试剂的方法,错误的是( )
| A. | 氢氟酸盛放在玻璃试剂瓶中 | |
| B. | 浓硝酸盛在棕色试剂瓶中 | |
| C. | 氢氧化钠溶液盛在带橡皮塞的玻璃瓶中 | |
| D. | 氯水盛在棕色试剂瓶中,并放置在冷暗处 |
11.下列化合物中,核磁共振氢谱只出现两组峰且峰面积之比为3:1的是( )
| A. | 对二甲苯 | B. | 2-丙醇 | C. | 2-甲基丙烯 | D. | 均三甲苯 |
18.在给定条件下,可以大量共存的离子组是( )
| A. | 含有0.1 mol•L-1 Fe3+的溶液中:H+、Fe2+、Na+、I- | |
| B. | 强碱性溶液中:K+、Al3+、Cl-、SO42- | |
| C. | 在pH=1的溶液中:Mg2+、Na+、ClO-、NO3- | |
| D. | 加入强碱再加热,既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、Cl- |
15.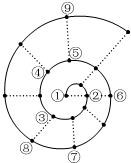 如果将前18号元素按原子序数递增的顺序排列,可形成图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中①点代表氢元素.下列有关说法正确的是( )
如果将前18号元素按原子序数递增的顺序排列,可形成图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中①点代表氢元素.下列有关说法正确的是( )
 如果将前18号元素按原子序数递增的顺序排列,可形成图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中①点代表氢元素.下列有关说法正确的是( )
如果将前18号元素按原子序数递增的顺序排列,可形成图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中①点代表氢元素.下列有关说法正确的是( )| A. | 最简单气态氢化物的稳定性:③比⑧强、⑤比⑨弱 | |
| B. | 最高价氧化物对应水化物的碱性:②比⑥强 | |
| C. | ⑦的最高价氧化物对应的水化物具有两性 | |
| D. | 简单离子半径④比⑥小 |
16.下列关于等质量的14CO2与N218O说法不正确的是( )
| A. | 分子数之比为1:1 | B. | 原子数之比为1:1 | C. | 中子数之比为1:1 | D. | 密度之比为1:1 |