题目内容
O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为 ,原子个数比为 .
(2)等温等压下,等体积的O2和O3所含分子个数比为 ,质量之比为 .
(3)配制100mL 1mol?L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g?mL-1,质量分数为98%)的体积为 mL.
(1)等质量的O2和O3所含分子个数比为
(2)等温等压下,等体积的O2和O3所含分子个数比为
(3)配制100mL 1mol?L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g?mL-1,质量分数为98%)的体积为
考点:阿伏加德罗常数,阿伏加德罗定律及推论,物质的量浓度的相关计算
专题:阿伏加德罗常数和阿伏加德罗定律,物质的量浓度和溶解度专题
分析:(1)根据n=
、N=
×NA、及分子构成计算;
(2)同温同压下,气体摩尔体积相同,N=
×NA、m=
及分子构成计算;
(3)根据稀释前后溶质的物质的量不变计算浓硫酸的体积.
| m |
| M |
| m |
| M |
(2)同温同压下,气体摩尔体积相同,N=
| V |
| Vm |
| V |
| Vm |
(3)根据稀释前后溶质的物质的量不变计算浓硫酸的体积.
解答:
解:(1)设其质量为m,等质量的O2和O3所含分子个数比=
×NA:
×NA:=3:2,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以其氧原子个数=(3×2):(2×3)=1:1;
故答案为:3:2;1:1;
(2)同温同压下,气体摩尔体积相同,根据N=
×NA知,等体积的O2和O3所含分子个数比是1:1,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以原子个数之比是2:3,根据m=
知,其质量之比等于其摩尔质量之比=32g/mol:48g/mol=2:3,故答案为:1:1;2:3;
(3)该浓H2SO4的物质的量浓度为:
c=
=
mol/L
=18.4 mol/L.
据稀释定律得:100 mL×1 mol/L=18.4 mol/L×V,
得V=5.4 mL,故答案为:5.4mL.
| mg |
| 32g/mol |
| mg |
| 48g/mol |
故答案为:3:2;1:1;
(2)同温同压下,气体摩尔体积相同,根据N=
| V |
| Vm |
| V |
| Vm |
(3)该浓H2SO4的物质的量浓度为:
c=
| 1000ml/L×ρ×w |
| M |
| 1000×1.84×98% |
| 98 |
=18.4 mol/L.
据稀释定律得:100 mL×1 mol/L=18.4 mol/L×V,
得V=5.4 mL,故答案为:5.4mL.
点评:本题考查阿伏伽德罗定律及其推论,灵活运用公式是解本题的关键,有关气体体积的计算要注意温度和压强,为易错点,题目难度中等.

练习册系列答案
 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
下列关于胶体的说法中正确的是( )
| A、胶体区别于其他分散系的本质特征是丁达尔现象 |
| B、利用滤纸可除去淀粉胶体中的少量NaCl |
| C、Fe(OH)3胶体带正电荷 |
| D、将直径为1~100纳米的Fe3O4颗粒均匀分散到水中,将得到Fe3O4胶体 |
元素符号、反应方程式、结构示意图、电子式、结构式等通常叫做化学用语.下列有关化学用语的表示方法中错误的是( )
A、异丁烷的结构式: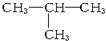 | ||
B、S2-的结构示意图: | ||
C、O-18的原子符号:
| ||
| D、CO2分子的结构式:O=C=O |
下列叙述正确的是( )
| A、1.00mol NaCl中含有6.02×1023个NaCl分子 |
| B、1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 |
| C、欲配置1.00L,1.00mol.L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 |
| D、用量筒取5.00mL 1.00mol?L-1盐酸于50 mL容量瓶中,加水稀释至刻度,可配制0.100mol?L-1盐酸 |
下列各选项内的物质化学式相同的是( )
| A、一氧化氮和二氧化氮 |
| B、干冰和二氧化碳 |
| C、乙醇和乙醛 |
| D、二氧化硫和三氧化硫 |
下列叙述正确的是( )
| A、摩尔是七个基本物理量之一 |
| B、1 mol任何物质都含有6.02×1023个分子 |
| C、标准状况下,1 mol任何物质体积均为22.4 L |
| D、摩尔质量在数值上等于该物质的相对分子质量或相对原子质量 |