题目内容
1.下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题: | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
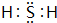 .
.(2)②、③、⑤元素的原子半径由大到小的顺序为Na>C>N.
(3)②、④、⑦元素的气态氢化物稳定性由强到弱的顺序是H2O>CH4>SiH4.
(4)有两种化合物A和B都由①④⑤⑧四种元素组成.若A与B在水溶液中能发生离子反应,则该反应的离子方程式为H++HSO3-=H2O+SO2↑.
(5)上述元素中最高价氧化物对应的水化物的酸性最强的是HClO4.
分析 由元素在周期表中位置可知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为S、⑧为S、⑨为Cl.
(1)⑧元素氢化物为H2S,分子中S原子与H原子之间形成1对共用电子对;
(2)同周期自左而右原子半径减小、同主族自上而下原子半径增大;
(3)元素非金属性越强,对应氢化物越稳定;
(4)有两种化合物A和B都由①④⑤⑧四种元素组成.若A与B在水溶液中能发生离子反应,应该是NaHSO3、NaHSO4反应;
(5)元素非金属性越强,最高价含氧酸的酸性越强.
解答 解:由元素在周期表中位置可知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为S、⑧为S、⑨为Cl.
(1)⑧元素氢化物为H2S,分子中S原子与H原子之间形成1对共用电子对,电子式为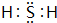 ,故答案为:
,故答案为: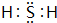 ;
;
(2)同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径为:Na>C>N,故答案为:Na>C>N;
(3)非金属性O>C>Si,元素非金属性越强,对应氢化物越稳定,故氢化物稳定性:H2O>CH4>SiH4,故答案为:H2O>CH4>SiH4;
(4)有两种化合物A和B都由①④⑤⑧四种元素组成.若A与B在水溶液中能发生离子反应,应该是NaHSO3、NaHSO4反应,反应的离子方程式为:H++HSO3-=H2O+SO2↑,故答案为:H++HSO3-=H2O+SO2↑;
(5)上述元素中最高价氧化物对应的水化物的酸性最强的是HClO4,故答案为:HClO4.
点评 本题考查元素周期表与元素周期律,侧重对元素周期律的考查,有利于基础知识的巩固,难度不大.

练习册系列答案
相关题目
1.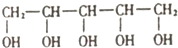 木糖醇原产于芬兰,是一种天热、健康的甜味剂,入口后往往伴有微微的清凉感,防龋齿,适合糖尿病患者的需要.它的结构简式如图.下列有关木糖醇的叙述错误的是( )
木糖醇原产于芬兰,是一种天热、健康的甜味剂,入口后往往伴有微微的清凉感,防龋齿,适合糖尿病患者的需要.它的结构简式如图.下列有关木糖醇的叙述错误的是( )
 木糖醇原产于芬兰,是一种天热、健康的甜味剂,入口后往往伴有微微的清凉感,防龋齿,适合糖尿病患者的需要.它的结构简式如图.下列有关木糖醇的叙述错误的是( )
木糖醇原产于芬兰,是一种天热、健康的甜味剂,入口后往往伴有微微的清凉感,防龋齿,适合糖尿病患者的需要.它的结构简式如图.下列有关木糖醇的叙述错误的是( )| A. | 木糖醇易溶于水,溶解过程的△H>0 | |
| B. | 一定条件下,木糖醇能与HCl反应,也能与醋酸反应,属于同一反应类型 | |
| C. | 木糖醇是一种单糖,不能发生水解反应 | |
| D. | 1mol木糖醇与足量的钠反应最多可产生2.5molH2 |
16.除去乙烷中混有的少量乙烯,正确的处理方法是( )
| A. | 将气体通入水 | B. | 将气体通入澄清石灰水 | ||
| C. | 将气体通入溴水 | D. | 将气体通入氯气进行光照 |
6.下列有关电池的说法不正确的是( )
| A. | 手机上用的锂离子电池属于二次电池 | |
| B. | 铅蓄电池放电时,负极的质量逐渐减小 | |
| C. | 氢氧燃料电池可把化学能转化为电能 | |
| D. | 锌锰干电池中,锌电极是负极 |
13.设NA为阿伏加德罗常数的值.下列叙述不正确的是( )
| A. | 7.80g Na2O2与5.85g NaCl所含阴离子数均为0.1NA | |
| B. | 一定条件下,1.4g N2与0.2mol H2混合充分反应,转移的电子数为0.3NA | |
| C. | 常温常压下,22.4LNH3所含分子数小于NA | |
| D. | 标准状况下,28g聚乙烯完全燃烧,产生的CO2数为2NA |
10. 乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示)填空:
乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示)填空:
(1)写出H2C2O4的电离方程式H2C2O4?H++HC2O4-、HC2O4-?H++C2O42-
(2)KHC2O4溶液显酸性的原因是HC2O4-的电离程度大于水解程度向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是AD
A.c(K+)═c(HC2O4-)+c(H2C2O4)+c(C2O42-) B.c(Na+)═c(H2C2O4)+c(C2O42-)
C.c(K+)+c(Na+)═c(HC2O4-)+c(C2O42-) D.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失.写出反应的离子方程式2MnO4-+5H2C2O4+6H+→2Mn2++10CO2↑+8H2O又知该反应开始时速率较慢,随后大大加快,可能的原因是生成的Mn2+对该反应具有催化作用
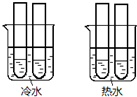
(4)某同学设计实验如图所示:两个烧杯中的试管都分别盛有2ml0.1mol/LH2C2O4溶液和4mL 0.1mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对反应速率的影响,但该实验始终没有看到溶液褪色,推测原因KMnO4溶液过量.
 乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示)填空:
乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示)填空:| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.1 | 8.1 |
(2)KHC2O4溶液显酸性的原因是HC2O4-的电离程度大于水解程度向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是AD
A.c(K+)═c(HC2O4-)+c(H2C2O4)+c(C2O42-) B.c(Na+)═c(H2C2O4)+c(C2O42-)
C.c(K+)+c(Na+)═c(HC2O4-)+c(C2O42-) D.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失.写出反应的离子方程式2MnO4-+5H2C2O4+6H+→2Mn2++10CO2↑+8H2O又知该反应开始时速率较慢,随后大大加快,可能的原因是生成的Mn2+对该反应具有催化作用
(4)某同学设计实验如图所示:两个烧杯中的试管都分别盛有2ml0.1mol/LH2C2O4溶液和4mL 0.1mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对反应速率的影响,但该实验始终没有看到溶液褪色,推测原因KMnO4溶液过量.
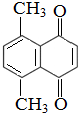
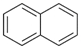 )的衍生物,且与A互为同分异构体.
)的衍生物,且与A互为同分异构体.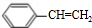 ,A分子中处于同一平面的原子最多有16个;
,A分子中处于同一平面的原子最多有16个;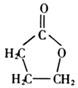 :
: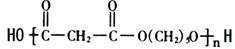 .
.