题目内容
16.除去乙烷中混有的少量乙烯,正确的处理方法是( )| A. | 将气体通入水 | B. | 将气体通入澄清石灰水 | ||
| C. | 将气体通入溴水 | D. | 将气体通入氯气进行光照 |
分析 结合乙烷和乙烯性质性质,除去乙烷中混有的少量乙烯时注意不能引入新的杂质,并且不能减少乙烷的量,乙烯能和溴水加成,能和高锰酸钾之间发生氧化还原反应,而乙烷则不能.
解答 解:A.二者都不溶于水,且通常情况下都与水不反应,不能用于除杂,故A错误;
B.通过石灰水时,乙烷和乙烯均不反应,故B错误;
C.通过溴水,乙烯被吸收,而乙烷不反应,可以除去乙烷中的乙烯,故C正确;
D.光照条件下都与氯气发生取代反应,不能用于除杂,故D错误.
故选C.
点评 本题考查物质的分离、提纯,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,除杂时不能引入新杂质,难度不大.

练习册系列答案
相关题目
16.下列表示对应化学反应的离子式方程式正确的是( )
| A. | 向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+2OH-=MgCO3↓+2H2O+CO32- | |
| B. | 漂白粉溶液中通入过量CO2气体:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | |
| C. | 向NH4Al(SO4)2溶液中逐渐滴入加入Ba(OH)2溶液恰好使SO42-反应完全: 2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O | |
| D. | FeBr2溶液中通入过量的Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
7.设阿佛加德罗常数为NA,下列叙述正确的是( )
| A. | 1摩尔H2O所含质子数为12NA | |
| B. | 2克氢气所含原子数为NA | |
| C. | 0.5摩尔单质铝与足量盐酸反应转移电子数为1.5NA | |
| D. | 标准状况下,1升水所含分子数为$\frac{1}{22.4}$ NA |
1.下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
(1)⑧元素氢化物的电子式是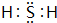 .
.
(2)②、③、⑤元素的原子半径由大到小的顺序为Na>C>N.
(3)②、④、⑦元素的气态氢化物稳定性由强到弱的顺序是H2O>CH4>SiH4.
(4)有两种化合物A和B都由①④⑤⑧四种元素组成.若A与B在水溶液中能发生离子反应,则该反应的离子方程式为H++HSO3-=H2O+SO2↑.
(5)上述元素中最高价氧化物对应的水化物的酸性最强的是HClO4.
 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
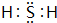 .
.(2)②、③、⑤元素的原子半径由大到小的顺序为Na>C>N.
(3)②、④、⑦元素的气态氢化物稳定性由强到弱的顺序是H2O>CH4>SiH4.
(4)有两种化合物A和B都由①④⑤⑧四种元素组成.若A与B在水溶液中能发生离子反应,则该反应的离子方程式为H++HSO3-=H2O+SO2↑.
(5)上述元素中最高价氧化物对应的水化物的酸性最强的是HClO4.
5.关于下列装置说法正确的是( )
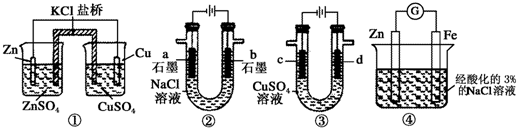

| A. | 装置①中,一段时间后SO42-浓度增大 | |
| B. | 装置②中滴入酚酞,a极附近变红 | |
| C. | 用装置③精炼铜时,c极为粗铜 | |
| D. | 装置④中发生吸氧腐蚀 |
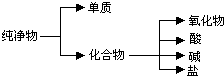 (1)纯净物根据其组成和性质可进行如图分类:如图所示的分类方法属于B(填序号)
(1)纯净物根据其组成和性质可进行如图分类:如图所示的分类方法属于B(填序号) ③白磷 ④氯气 ⑤2,2-二甲基丁烷 ⑥氯水 ⑦
③白磷 ④氯气 ⑤2,2-二甲基丁烷 ⑥氯水 ⑦ ⑧CH3(CH2)3CH3 ⑨${\;}_{17}^{35}$Cl ⑩红磷⑪${\;}_{17}^{37}$Cl⑫
⑧CH3(CH2)3CH3 ⑨${\;}_{17}^{35}$Cl ⑩红磷⑪${\;}_{17}^{37}$Cl⑫ ⑬CH2=CH2⑭CH2=CH-CH=CH2
⑬CH2=CH2⑭CH2=CH-CH=CH2 ;取代反应.
;取代反应. ;取代反应.
;取代反应. ;加聚反应.
;加聚反应.
 将0.1molMg、Al混合物溶于100mL4mol/L的盐酸中,然后再滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m与NaOH溶液的体积V的变化如图所示.
将0.1molMg、Al混合物溶于100mL4mol/L的盐酸中,然后再滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m与NaOH溶液的体积V的变化如图所示.