题目内容
下列说法正确的是( )
| A、碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力 |
| B、分子晶体中都存在共价键 |
| C、氯化氢和氯化钾的溶解克服相同类型作用力 |
| D、在晶体中只要有阴离子就一定有阳离子 |
考点:不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:根据分析晶体的类型,判断每种物质存在的作用力,注意化学键与分子间作用力的区别.
解答:
解:A、碘单质的晶体属于分子晶体,加热晶体碘使之变成蒸气克服分子间作用力,故A错误;
B、稀有气体分子都是单原子分子,不存在共价键,故B错误;
C、氯化氢是分子晶体,氯化钾是离子晶体,溶解二者克服的作用力分别为共价键、离子键,故C错误;
D、由电荷守恒可知在晶体中只要有阴离子就一定有阳离子,故D正确.
故选:D.
B、稀有气体分子都是单原子分子,不存在共价键,故B错误;
C、氯化氢是分子晶体,氯化钾是离子晶体,溶解二者克服的作用力分别为共价键、离子键,故C错误;
D、由电荷守恒可知在晶体中只要有阴离子就一定有阳离子,故D正确.
故选:D.
点评:本题考查晶体类型以及微粒间的作用力,题目难度不大,注意晶体的类型以及微粒间的作用力类型.

练习册系列答案
相关题目
能正确表示下列化学反应的离子方程式是( )
| A、过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| B、硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ |
| C、NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O |
D、苯酚钠溶液中通入少量CO2:2 -O-+CO2+H2O=2 -O-+CO2+H2O=2 -OH+CO32- -OH+CO32- |
一定条件下,在容积固定的某密闭容器中发生的反应N2+3H2?2NH3.在10s内N2的浓度由5mol/L降至4mol/L.下列说法正确的是 ( )
| A、用NH3表示的化学反应速率为0.1 mol/(L?s) |
| B、维持容积的体积不变充入氩气,会加快该反应的速率 |
| C、增加H2的浓度该正反应速率和逆反应速率都会加快 |
| D、反应足够长时间,N2、H2中至少有一种物质浓度降为零 |
在化肥和农药的使用过程中,下列操作中,正确的是( )
| A、为了提高含氮量,可以不必考虑使用过程中化肥对土壤产生的不良影响 |
| B、碱性的草木灰与含可溶性的Ca(H2PO4)2混合使用 |
| C、为增强作物的抗寒、抗旱能力,可以适当的使用一些磷肥 |
| D、使用了某一效果显著的杀虫剂后,可以不必更换品牌,长期使用 |
下列说法正确的是( )
| A、分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
| B、能自发进行的化学反应,一定是△H<0、△S>0 |
| C、焰色反应是物质燃烧时火焰呈现的颜色变化,属于化学变化 |
| D、钢铁发生电化学腐蚀时,负极的电极反应式为 Fe-3e-=Fe3+ |
下列各组离子一定能大量共存的是( )
| A、在无色溶液中:K+、SO42-、Cu2+、NO3- |
| B、在强碱溶液中:Na+、K+、CO32-、NO3- |
| C、常温下,在pH=2的溶液中:K+、Na+、SO42-、Cl- |
| D、在c(H+)=0.1mol?L-1的溶液中:K+、I-、Cl-、NO3- |
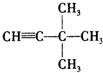
 表格中的各种情况,可用如图象表示的是( )
表格中的各种情况,可用如图象表示的是( )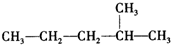 :
: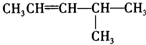 :
: :
: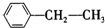 :
: