题目内容
一定条件下存在反应:2SO2(g)+O2(g) 2SO3(g),△H<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
2SO3(g),△H<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是

A.容器I、Ⅲ中平衡常数相同
B.容器II、Ⅲ中正反应速率相同
C.SO3的体积分数:Ⅱ>III
D.容器Ⅰ中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1
D
【解析】
试题分析:2SO2(g)+O2(g)  2SO3(g)的正反应是气体体积减小的放热反应,A.由于容器I是在绝热条件下进行,反应后温度升高,而Ⅲ是在恒温下进行的,反应温度不同,所以平衡常数就不相同 ,错误;B.正反应是气体体积减小的反应,容器Ⅱ、Ⅲ中反应温度虽然相同,而容器Ⅱ在恒容下进行,反应后压强比原来下,而Ⅲ中是在恒压下进行的,压强与原来相同不变,所以Ⅲ的压强大于Ⅱ,增大压强,化学反应速率加快,故二者的正反应速率Ⅲ>Ⅱ,不相同,错误;C.Ⅱ、Ⅲ 温度相同,而压强Ⅱ<Ⅲ ,增大压强,平衡向气体体积减小的方向,即平衡向正反应方向移动,所以平衡时SO3的体积分数:Ⅲ >Ⅱ,错误;D.由于容器Ⅰ中是在恒容绝热条件下进行的,正反应是放热反应,升高温度平衡逆向移动,反应达到平衡时SO2的转化率比恒温恒容条件下反应达到平衡时SO2的转化率小,在恒温恒容条件下反应从正反应方向开始与从逆反应方向开始的是等效平衡,SO2的转化率与SO3的转化率之和等于1,因为容器Ⅰ中平衡逆向移动了,所以容器Ⅰ中SO2的转化率与容器II 中SO3的转化率的和小于1,正确。
2SO3(g)的正反应是气体体积减小的放热反应,A.由于容器I是在绝热条件下进行,反应后温度升高,而Ⅲ是在恒温下进行的,反应温度不同,所以平衡常数就不相同 ,错误;B.正反应是气体体积减小的反应,容器Ⅱ、Ⅲ中反应温度虽然相同,而容器Ⅱ在恒容下进行,反应后压强比原来下,而Ⅲ中是在恒压下进行的,压强与原来相同不变,所以Ⅲ的压强大于Ⅱ,增大压强,化学反应速率加快,故二者的正反应速率Ⅲ>Ⅱ,不相同,错误;C.Ⅱ、Ⅲ 温度相同,而压强Ⅱ<Ⅲ ,增大压强,平衡向气体体积减小的方向,即平衡向正反应方向移动,所以平衡时SO3的体积分数:Ⅲ >Ⅱ,错误;D.由于容器Ⅰ中是在恒容绝热条件下进行的,正反应是放热反应,升高温度平衡逆向移动,反应达到平衡时SO2的转化率比恒温恒容条件下反应达到平衡时SO2的转化率小,在恒温恒容条件下反应从正反应方向开始与从逆反应方向开始的是等效平衡,SO2的转化率与SO3的转化率之和等于1,因为容器Ⅰ中平衡逆向移动了,所以容器Ⅰ中SO2的转化率与容器II 中SO3的转化率的和小于1,正确。
考点:考查不同条件下同一反应的化学反应速率、物质的平衡转化率及平衡常数的计算的知识。

 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案(8分)2013年以来全国各地都遭遇“十面霾伏”。其中,二氧化硫、氮氧化物和可吸入颗粒物是雾霾的主要组成成分。综合治理其污染是环境化学当前的重要研究内容。
(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:
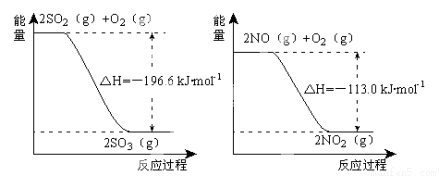
则NO2氧化SO2的热化学方程式为 _____________________________ 。
(2)SO2与O2反应时的平衡转化率与温度、压强的关系如图所示。根据图示回答下列问题:

①压强:Pl P2(填“>”、“=”或“<”)。
②平衡常数:A点 B点(填“>”、“=”或“<”)。
③200℃下,将一定量的SO2和O2充人体积为1 L的密闭容器中,经10min后测得容器中各物质的物质的量如下表所示:
气体 | SO2 | O2 | SO3 |
物质的量(mol) | 1.6 | 1.8 | 0.4 |
10min内该反应的反应速率v(O2)= ;该反应达到化学平衡状态的标志是 。
a.SO2和O2的体积比保持不变 b.体系的压强保持不变
c.混合气体的密度保持不变 d.SO2和SO3物质的量之和保持不变
(3)用NH3催化还原NOx可以消除氮氧化物的污染。
①写出氨气消除NO污染的化学方程式 ___________________________ ;
②若还原产物比氧化产物多0.5mol,则反应转移电子数为 ________ 。

 N
N  K
K
 2SOCl2 (g) △H=a kJ·mol-1
2SOCl2 (g) △H=a kJ·mol-1 (g)
(g) SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图-1。
SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图-1。
 反应的化学方程式为 。
反应的化学方程式为 。