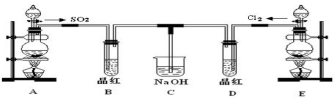
题目内容
12.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 常温常压下,14g由N2和CO组成的混合气体中含有的电子总数为7 NA | |
| B. | 常温下,1 L pH=1的硫酸溶液中含有的H+数目为0.2 NA | |
| C. | 1 L 0.1 mol/L Na2CO3溶液中含有的CO32-数目为0.1 NA | |
| D. | 一定条件下,6.4 g SO2和足量的O2充分反应后,生成SO3的分子数为0.1NA |
分析 A.氮气和CO的摩尔质量均为28g/mol,且均含14个电子;
B.pH=1的硫酸溶液,氢离子浓度为0.1mol/L;
C.碳酸根离子为弱酸根离子,水溶液中部分发生水解;
D.二氧化硫与氧气为可逆反应.
解答 解:A.氮气和CO的摩尔质量均为28g/mol,故14g混合物的物质的量为0.5mol,且两者均含14个电子,故0.5mol混合物中含7NA个电子,故A正确;
B.pH=1的硫酸溶液,氢离子浓度为0.1mol/L,1 L pH=1的硫酸溶液中含有的H+数目为0.1NA,故B错误;
C.碳酸根离子为弱酸根离子,水溶液中部分发生水解,所以1 L 0.1 mol/L Na2CO3溶液中含有的CO32-数目小于0.1 NA,故C错误;
D.二氧化硫与氧气为可逆反应,可逆反应不能进行到底,一定条件下,6.4 g SO2和足量的O2充分反应后,生成SO3的分子数小于0.1NA,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的判断及计算,熟悉以物质的量为核心的相关计算公式是解题关键,注意可逆反应不能进行到底的特点,题目难度不大.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
2.用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示.下列说法正确的是( )


| A. | 燃料电池工作时,正极反应为O2+2H2O+4e-═4OH- | |
| B. | 此装置用于铁表面镀铜时,a为铁b为Cu,工作一段时间要使右池溶液复原可加入适量的CuO | |
| C. | a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 | |
| D. | 若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的H2体积相同 |
3.NA为阿伏伽德罗常数的值,下列叙述错误的是( )
| A. | 两份质量均为27 g的 Al分别与足量NaOH溶液和足量的盐酸反应转移电子均为3NA | |
| B. | 1mol氯气与足量的铁反应,转移电子数目是3NA | |
| C. | 46 g NO2和N2O4混合气体中含有原子总数为3 NA | |
| D. | 23 g Na 与足量 O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
20.下列说法正确的是( )
| A. | 酸雨是指PH<7的雨水,酸雨长时间放置,酸性变强 | |
| B. | 用排空气法收集NO | |
| C. | 用加热浓氨水的方法可以快速制氨气,经氯化钙干燥后得到纯净的氨气 | |
| D. | 2NH3+Cl2=6HCl+N2,因此可以用浓氨水检验氯气的管道是否漏气 |
17.下列常见物质的主要成分与化学式相对应的是( )
| A. | 光导纤维一Si | B. | 铝土矿一Al2O3 | C. | 磁铁矿一Fe2O3 | D. | 纯碱一NaOH |
4.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 足量Na与1 mol Cl2完全反应,转移电子的数目为2NA | |
| B. | 1L 1 mol﹒L-1NaOH水溶液中含有的氧原子数为NA | |
| C. | 通常状况下,NA个N2所占的体积约为22.4L | |
| D. | 1molNa2O2中含有的阴离子数为2NA |
1.水溶液中能大量共存的一组离子是( )
| A. | Na+、Ca2+、Cl-、SO42- | B. | Fe2+、H+、SO32-、NO3- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、Fe3+、NO3-、OH- |
2.四氟乙烯(CF2=CF2)是合成聚四氟乙烯(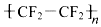 )的材料.
)的材料.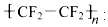 是不粘锅涂覆物质的主要成分.下列有关说法不正确的是( )
是不粘锅涂覆物质的主要成分.下列有关说法不正确的是( )
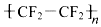 )的材料.
)的材料.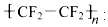 是不粘锅涂覆物质的主要成分.下列有关说法不正确的是( )
是不粘锅涂覆物质的主要成分.下列有关说法不正确的是( )| A. | CF2=CF2能使溴的CCl4溶液褪色 | |
| B. | 四氟乙烯合成聚四氟乙烯属于加聚反应 | |
| C. | 1molCF2=CF2只能与1molH2发生加成反应 | |
| D. | 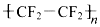 能使高锰酸钾酸性溶液褪色 能使高锰酸钾酸性溶液褪色 |