题目内容
14.在反应KMnO4+HCl(浓)→MnCl2+KCl+Cl2↑+H2O中,(1)配平上述化学方程式2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O.
(2)若生成35.5g Cl2,则被氧化的HCl是1mol,转移的电子的物质的量是1mol.
分析 KMnO4+HCl(浓)→MnCl2+KCl+Cl2↑+H2O反应中,Mn的化合价从+7价降低到+2价,Cl的化合价从-1价升高到0价,则配平方程式为2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O,以此来解答
解答 解:(1)KMnO4+HCl(浓)→MnCl2+KCl+Cl2↑+H2O反应中,Mn的化合价从+7价降低到+2价,Cl的化合价从-1价升高到0价,则配平方程式为2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O;
故答案为:2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O;
(2)若生成35.5g Cl2,则氯气的物质的量为$\frac{35.5g}{71g/mol}$=0.5mol,则被氧化的HCl为1mol,转移电子为1mol;
故答案为:1;1mol.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,注意从元素化合价的角度认识相关概念和物质的性质,难度不大.

练习册系列答案
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
4. 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为MnSO4.
(2)已知反应2HI(g)=H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g) 分子中化学键断裂时需吸收的能量为299kJ.
(3)Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g)
716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
①根据上述实验结果,该反应的平衡常数K的表达式为:$\frac{0.108×0.108}{0.78{4}^{2}}$.
②上述反应中,正反应速率为v正=k正•x2(HI),逆反应速率为v逆=k逆•x(H2)•x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{k}_{正}}{K}$(以K和k正表示).若k正=0.0027min-1,在t=40min时,v正=1.95×10-3min-1
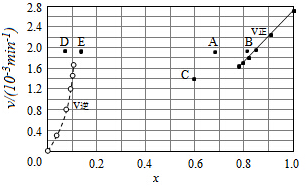
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为A、E(填字母)
 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为MnSO4.
(2)已知反应2HI(g)=H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g) 分子中化学键断裂时需吸收的能量为299kJ.
(3)Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g)
716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
②上述反应中,正反应速率为v正=k正•x2(HI),逆反应速率为v逆=k逆•x(H2)•x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{k}_{正}}{K}$(以K和k正表示).若k正=0.0027min-1,在t=40min时,v正=1.95×10-3min-1
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为A、E(填字母)
2.某些含羟基的药物具有苦味,如以下结构的氯霉素: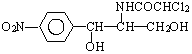 .此药物分子中碳链末端羟基(-OH)中的氢原子换成来自棕榈酸中的原子团
.此药物分子中碳链末端羟基(-OH)中的氢原子换成来自棕榈酸中的原子团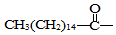 后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
 .此药物分子中碳链末端羟基(-OH)中的氢原子换成来自棕榈酸中的原子团
.此药物分子中碳链末端羟基(-OH)中的氢原子换成来自棕榈酸中的原子团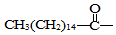 后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )| A. | 它是棕榈酸的盐类 | B. | 它不是棕榈酸的酯类 | ||
| C. | 它的水溶性变差,所以苦味消失 | D. | 它的水溶性变良,所以苦味消失 |
19.等质量的CO和N2,下列叙述不正确的是( )
| A. | 密度一定相同 | B. | 分子数一定相同 | ||
| C. | 原子数一定相同 | D. | 物质的量一定相同 |
6.可逆反应:2NO2?2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②NO2与NO速率相等
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
⑦混合气体的压强不再改变的状态.
①单位时间内生成nmolO2的同时生成2nmolNO2
②NO2与NO速率相等
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
⑦混合气体的压强不再改变的状态.
| A. | ①④⑥⑦ | B. | ②③⑤ | C. | ①②④⑥⑦ | D. | ①②③④⑥⑦ |
3.下列说法中正确的是( )
| A. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ca2+ | |
| B. | 某溶液与NaOH溶液共热,产生使湿润红色石蕊试纸变蓝气体,说明原溶液中存在NH4+ | |
| C. | 某溶液加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,则一定含有CO32- | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
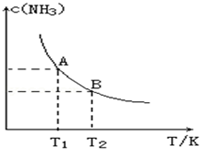 在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.
在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.