题目内容
对下列一些实验事实的理论解释,错误的是( )
| 选项 | 实验事实 | 理论解释 |
| A | P原子的第一电离能大于S原子 | 磷原子的半径比硫原子的半径大 |
| B | 乙烯的化学性质比乙烷活泼 | 乙烯分子结构中存在π键 |
| C | 向加入过量氨水的硫酸铜溶液中加入乙醇,将析出深蓝色晶体 | 乙醇的加入降低了[Cu(NH3)4]SO4?H2O的溶解度 |
| D | HCl气体极易溶于水 | HCl和H2O均为极性分子 |
| A、A | B、B | C、C | D、D |
考点:元素电离能、电负性的含义及应用,极性分子和非极性分子,有机化学反应的综合应用
专题:
分析:A、P原子3p能级半充满,所以比较稳定,难以失去电子;
B、根据结构决定性质分析;
C、根据[Cu(NH3)4]SO4?H2O的溶解度在乙醇中比水中要小分析;
D、根据相似相溶原理分析.
B、根据结构决定性质分析;
C、根据[Cu(NH3)4]SO4?H2O的溶解度在乙醇中比水中要小分析;
D、根据相似相溶原理分析.
解答:
解:A.P原子3p能级半充满,所以比较稳定,P原子的第一电离能大于S原子,故A错误;
B.乙烯分子结构中存在π键而乙烷没有,所以乙烯的化学性质比乙烷活泼,故B正确;
C.因为[Cu(NH3)4]SO4?H2O的溶解度在乙醇中比水中要小,所以向加入过量氨水的硫酸铜溶液中加入乙醇,将析出深蓝色晶体,故C正确;
D.因为HCl和H2O均为极性分子,根据相似相溶原理,所以HCl气体极易溶于水,故D正确.
故选A.
B.乙烯分子结构中存在π键而乙烷没有,所以乙烯的化学性质比乙烷活泼,故B正确;
C.因为[Cu(NH3)4]SO4?H2O的溶解度在乙醇中比水中要小,所以向加入过量氨水的硫酸铜溶液中加入乙醇,将析出深蓝色晶体,故C正确;
D.因为HCl和H2O均为极性分子,根据相似相溶原理,所以HCl气体极易溶于水,故D正确.
故选A.
点评:本题考查物质结构与性质知识,难度不大,注意知识的积累.

练习册系列答案
相关题目
可以说明乙酸是弱酸的事实是( )
| A、乙酸不能使酚酞溶液变红色 |
| B、0.1 mol?L-1的乙酸溶液pH>1 |
| C、乙酸能使紫色石蕊试液变红色 |
| D、乙酸和Na2CO3反应可放出CO2 |
根据如图,下列判断中正确的是( )
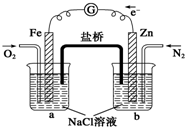

| A、烧杯a中的溶液pH不变 |
| B、烧杯a中发生氧化反应 |
| C、烧杯b中发生的反应为Zn-2e-=Zn2+ |
| D、烧杯a中发生的反应为2H2O+2e-=H2↑+2OH- |
下列应用涉及的反应属于非氧化还原反应的是( )
A、 在如图所示装置中制氨气 |
| B、利用铝热反应焊接铁轨 |
| C、通过合成氨实现人工固氮 |
| D、过氧化钠用作呼吸面具的供氧剂 |
实验室制Cl2的反应为4HCl(浓)+MnO2═MnCl2+C12↑+2H2O,下列说法错误的是( )
| A、还原剂是HCl,氧化剂是MnO2 |
| B、每生成1 molCl2,转移电子的物质的量为2 mol |
| C、每消耗1 molMnO2,起还原剂作用的HCl消耗4mol |
| D、生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质 |
磷中毒可用硫酸铜解毒,反应方程式为:11P+15CuSO4+24H20═5Cu3P+6H3PO4+15H2SO4分析反应,下列说法错误的是( )
| A、P既是氯化剂又是还原剂 |
| B、Cu3P既是氧化产物又是还原产物 |
| C、CuSO4发生了还原反应 |
| D、当生成lmol Cu3P时,转移电子的物质的量为6 mol |
一定量的铜和浓硫酸在加热条件下充分反应:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O.向反应后显酸性的溶液只能逐滴加入含amolNaOH的溶液,恰好使反应后的溶液呈中性,则下列叙述错误的是( )
| ||
| A、溶液中c(Na+)=2c(SO42-) | ||
B、沉淀的物质的量等于
| ||
| C、标况下,生成SO2的体积<11.2aL | ||
D、原浓硫酸中H2SO4的物质的量>
|