题目内容
工业上通常把溶液中存在的CO
和HCO
的总浓度称为总碱度.水中碱度的控制成为碳酸钠软化水处理法的关键.从理论上分析,碳酸在水中一般以3种形态存在,即H2CO3(CO2)、CO
和HCO
.根据碳酸的平衡理论,不同pH值时水中的碳酸存在形态及含量见图.
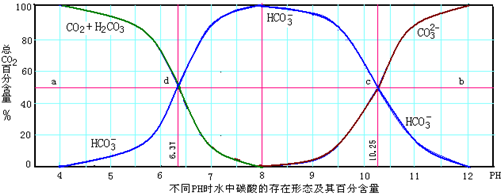
(1)从图中推断NaHCO3溶液呈 性(填“酸”、“碱”、或“中”),其原因是 .
(2)根据上图,下列叙述中正确的是:
A、HCO
既与强酸反应又与强碱反应.
B、1.0mol/L盐酸滴定1.0mol/L的碳酸钠溶液恰好反应时呈中性
C、二氧化碳在血液中多以HCO
的形式存在
D、在pH值为6.37及10.25时,溶液中的c(H2CO3)=c(HCO
)=c(CO
)
(3)为了保证生产系统不产生结垢现象,要求体系中的c(CO32-)≤0.3mmol/L,已知在该温度下Ksp(CaCO3)=3.03×10-9,则体系中的c(CO
)的取值范围为 .
(4)转炉烟气洗涤水的pH通常在11左右,当某水样中总碱度为10mmol/L时,该水样能否保证不结垢? 理由是 ,此时水溶液存在的阴离子浓度从大到小的顺序为 .
2- 3 |
- 3 |
2- 3 |
- 3 |

(1)从图中推断NaHCO3溶液呈
(2)根据上图,下列叙述中正确的是:
A、HCO
- 3 |
B、1.0mol/L盐酸滴定1.0mol/L的碳酸钠溶液恰好反应时呈中性
C、二氧化碳在血液中多以HCO
- 3 |
D、在pH值为6.37及10.25时,溶液中的c(H2CO3)=c(HCO
- 3 |
2- 3 |
(3)为了保证生产系统不产生结垢现象,要求体系中的c(CO32-)≤0.3mmol/L,已知在该温度下Ksp(CaCO3)=3.03×10-9,则体系中的c(CO
2- 3 |
(4)转炉烟气洗涤水的pH通常在11左右,当某水样中总碱度为10mmol/L时,该水样能否保证不结垢?
考点:盐类水解的原理,影响盐类水解程度的主要因素
专题:盐类的水解专题
分析:(1)根据图中溶液中碳酸氢根离子浓度最大时,溶液的pH情况来分析;
(2)A、HCO3-既与强酸反应又与强碱反应;
B、1.0mol/L盐酸滴定1.0mol/L的碳酸钠溶液恰好反应得到的溶液是碳酸氢钠和氯化钠;
C、正常人体血液pH保持在7.35~7.45,据此回答;
D、根据图示内容,在pH值为6.37及10.25时,溶液中的c(H2CO3)、c(HCO3-)、c(CO32-)的浓度关系来回答;
(3)保证生产系统不产生结垢现象,即Qc≤Ksp即可;
(4)根据图中内容,离子的存在和溶液pH之间的关系结合沉淀的形成条件来回答.
(2)A、HCO3-既与强酸反应又与强碱反应;
B、1.0mol/L盐酸滴定1.0mol/L的碳酸钠溶液恰好反应得到的溶液是碳酸氢钠和氯化钠;
C、正常人体血液pH保持在7.35~7.45,据此回答;
D、根据图示内容,在pH值为6.37及10.25时,溶液中的c(H2CO3)、c(HCO3-)、c(CO32-)的浓度关系来回答;
(3)保证生产系统不产生结垢现象,即Qc≤Ksp即可;
(4)根据图中内容,离子的存在和溶液pH之间的关系结合沉淀的形成条件来回答.
解答:
解:(1)根据图中所示,PH约等于8时,c (HCO3-)最大,c (CO32-)最少,碳酸氢根离子几乎不电离,溶液显示碱性,
故答案为:碱;PH约等于8时,c (HCO3-)最大,c (CO32-)最少,说明HCO3-极少电离;
(2)A、HCO3-既与强酸反应生成二氧化碳和水,又与强碱反应生成碳酸盐和水,故A正确;
B、1.0mol/L盐酸滴定1.0mol/L的碳酸钠溶液恰好反应得到的溶液是碳酸氢钠和氯化钠,溶液不一定是中性的,故B错误;
C、正常人体血液pH保持在7.35~7.45,在此pH范围内,根据表中数据,二氧化碳在血液中多以碳酸氢根离子的形式存在,故C正确;
D、根据图示内容,在pH值为6.37及10.25时,溶液中的c(H2CO3)、c(HCO3-)、c(CO32-)的浓度是不相等的,故D错误;
故选AC;
(3)根据沉淀形成条件,为了保证生产系统不产生结垢现象,即Qc≤Ksp,Ksp=c(Ca2+)?c(CO32-),则c(CO32-)≥1.01×10-5,
故答案为:c (CO32-)≥1.01×10-5;
(4)根据表中信息知道,PH═11时,溶液中主要存在的是碳酸根离子和碳酸氢根离子,并且碳酸根离子大于碳酸氢根离子的浓度,即c (CO32-)>c (HCO3-)>c (OH-),根据C原子守恒,PH═11时,CO32-占总碳元素含量的50%以上,并且浓度为CO32-最低浓度的500倍以上,这样的环境足以保证CaCO3沉淀,
故答案为:能;因为PH═11时,CO32-占总碳元素含量的50%以上,浓度为CO32-最低浓度的500倍以上,足以保证CaCO3沉淀,即Ca2+有效去除;
c (CO32-)>c (HCO3-)>c (OH-).
故答案为:碱;PH约等于8时,c (HCO3-)最大,c (CO32-)最少,说明HCO3-极少电离;
(2)A、HCO3-既与强酸反应生成二氧化碳和水,又与强碱反应生成碳酸盐和水,故A正确;
B、1.0mol/L盐酸滴定1.0mol/L的碳酸钠溶液恰好反应得到的溶液是碳酸氢钠和氯化钠,溶液不一定是中性的,故B错误;
C、正常人体血液pH保持在7.35~7.45,在此pH范围内,根据表中数据,二氧化碳在血液中多以碳酸氢根离子的形式存在,故C正确;
D、根据图示内容,在pH值为6.37及10.25时,溶液中的c(H2CO3)、c(HCO3-)、c(CO32-)的浓度是不相等的,故D错误;
故选AC;
(3)根据沉淀形成条件,为了保证生产系统不产生结垢现象,即Qc≤Ksp,Ksp=c(Ca2+)?c(CO32-),则c(CO32-)≥1.01×10-5,
故答案为:c (CO32-)≥1.01×10-5;
(4)根据表中信息知道,PH═11时,溶液中主要存在的是碳酸根离子和碳酸氢根离子,并且碳酸根离子大于碳酸氢根离子的浓度,即c (CO32-)>c (HCO3-)>c (OH-),根据C原子守恒,PH═11时,CO32-占总碳元素含量的50%以上,并且浓度为CO32-最低浓度的500倍以上,这样的环境足以保证CaCO3沉淀,
故答案为:能;因为PH═11时,CO32-占总碳元素含量的50%以上,浓度为CO32-最低浓度的500倍以上,足以保证CaCO3沉淀,即Ca2+有效去除;
c (CO32-)>c (HCO3-)>c (OH-).
点评:本题考查学生盐的水解原理以及盐的水解的影响因素知识,注意知识的归纳和整理是关键,结合图象考查,增加了难度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
党的十八大报告指出:加强节能降耗,支持节能低碳产业和新能源、可再生能源发展,确保国家能源安全.下列各项措施中,与上述精神相悖的是( )
| A、大力开发和利用生物质能,促进可再生能源的发展 |
| B、利用核能、水库、潮汐等发电,可以减少火力发电对煤等化石燃料的使用 |
| C、H2是理想的绿色能源,可用电解水的方法进行获得 |
| D、推广利用太阳能、风能的照明系统,有利于实现城市的“蓝天工程” |
 甲、乙、丙、丁四种物质之间存在如图所示转化关系,且甲、乙、丙均含有相同的某种元素.下列推断错误的是( )
甲、乙、丙、丁四种物质之间存在如图所示转化关系,且甲、乙、丙均含有相同的某种元素.下列推断错误的是( )| A、若甲为焦炭,则丁可能是O2 |
| B、若甲为N2,则丙可能是NO2 |
| C、若甲为Cl2,则丁可能是Fe |
| D、若甲为NaOH溶液,则丁可能是CO2 |
在25℃,将pH=11的NaOH溶液a mL与pH=1的H2SO4溶液b mL混合,当恰好完全中和时,a与b的比值为( )
| A、1000:1 | B、100:1 |
| C、50:1 | D、10:1 |

 回答下面关于有机实验的问题.
回答下面关于有机实验的问题.
 (1)25℃时,部分弱酸的电离平衡常数如下表:
(1)25℃时,部分弱酸的电离平衡常数如下表: