题目内容
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表.请从下表实验现象(Ⅱ)中选出与方案(Ⅰ)对应的实验现象,将其序号(A,B,C…)填入(Ⅲ)中,并写出相应的化学方程式.

通过以上实验分析了同周期元素的符号是________,从实验结果可以得出的结论是________;从结构理论上简单说明具有上述结论的原因:________.
答案:
解析:
解析:
|
Na,Mg,Al,S,Cl,在同一周期的元素从左到右随原子序数的递增金属性逐渐减弱,非金属性逐渐增强,同一周期的元素,从左到右随原子序数的递增,原子半径逐渐减小,核对外层电子的吸引力逐渐增强,因而得电子的能力逐渐增强,失电子的能力逐渐减弱,表现在化学性质上,即元素的金属性逐渐减弱,非金属性逐渐增强 |

练习册系列答案
相关题目

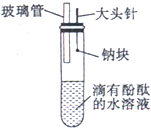 某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表.
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表.