题目内容
下列离子方程式中,正确的是( )
| A、氧化亚铁与稀盐酸反应:FeO+2H+=Fe3++H2O |
| B、向氯化铜溶液中加入氢氧化钠溶液:Cu2++OH-=Cu(OH)2↓ |
| C、氯化铁溶液与铜反应:Fe3++Cu=Cu2++Fe2+ |
| D、向氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.电荷不守恒;
B.原子个数不守恒;
C.电荷不守恒、得失电子不守恒;
D.向氯化亚铁溶液中通入氯气,反应生成氯化亚铁.
B.原子个数不守恒;
C.电荷不守恒、得失电子不守恒;
D.向氯化亚铁溶液中通入氯气,反应生成氯化亚铁.
解答:
解:A.氧化亚铁与稀盐酸反应,离子方程式:FeO+2H+=Fe2++H2O,故A错误;
B.向氯化铜溶液中加入氢氧化钠溶液,离子方程式:Cu2++2OH-=Cu(OH)2↓,故B错误;
C.氯化铁溶液与铜反应,离子方程式:2Fe3++Cu=Cu2++2Fe2+,故C错误;
D.氯化亚铁溶液中通入氯气,离子方程式:2Fe2++Cl2=2Fe3++2Cl-,故D正确;
故选:D.
B.向氯化铜溶液中加入氢氧化钠溶液,离子方程式:Cu2++2OH-=Cu(OH)2↓,故B错误;
C.氯化铁溶液与铜反应,离子方程式:2Fe3++Cu=Cu2++2Fe2+,故C错误;
D.氯化亚铁溶液中通入氯气,离子方程式:2Fe2++Cl2=2Fe3++2Cl-,故D正确;
故选:D.
点评:本题考查离子反应的书写,为高频考点,明确反应的实质是解题关键,注意化学式的拆分、原子个数、电荷数守恒,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
升高温度,下列数据不一定增大的是( )
| A、化学反应速率v |
| B、弱电解质的电离平衡常数Ka |
| C、化学平衡常数K |
| D、水的离子积常数KW |
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.下列有关该电池设计的说法不正确的是( )
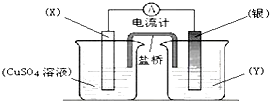

| A、电极X的材料是Cu |
| B、银电极为正极 |
| C、盐桥里Cl-移向电源的负极 |
| D、外电路中每通过0.2mol电子,银电极的质量理论上增加10.8g |
在100mL混合液中,硝酸和硫酸的物质的量浓度分别为1mol/L和4mol/L,向该混合液中加入32.5g锌,微热充分反应后,收集到标准状况下的气体为( )
| A、2.24 L |
| B、7.84 L |
| C、10.08 L |
| D、11.2 L |
设阿伏加德罗常数为NA,下列说法正确的是( )
| A、1 mol Cl2与足量Fe反应,转移的电子数为3NA |
| B、常温常压下,14g氮气中含有 NA个原子 |
| C、标准状况下,22.4L水中含有的原子数为3NA |
| D、在25℃、101 kPa时,22.4 L氢气中含有NA个氢分子 |
下列关于铜电极的叙述中不正确的是( )
| A、铜锌原电池中铜是正极 |
| B、在镀件上镀铜时可以用金属铜作阳极 |
| C、用电解法精炼粗铜时粗铜作阴极 |
| D、镀铜的铁器,若发生缺损易形成以铜为正极的原电池 |