题目内容
17.下列化学方程式或离子方程式正确的是( )| A. | 用铜做电极电解CuSO4溶液:2Cu2++2H2O=2Cu↓+O2↑+4H+ | |
| B. | 惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑ | |
| C. | 乙醛溶液中加入新制碱性Cu(OH)2悬浊液并加热CH3CHO+2 Cu(OH)2+OH-$\stackrel{△}{→}$ CH3COO-+Cu2O↓+3H2O | |
| D. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ |
分析 A.铜为活性电极,电极本身放电;
B.惰性电极电解MgCl2溶液,阳极是氯离子放电生成氯气,阴极是溶液中氢离子放电生成氢气,溶液中氢氧根离子结合镁离子生成氢氧化镁沉淀;
C.乙醛溶液中加入新制碱性Cu(OH)2悬浊液并加热生成红色沉淀氧化亚铜,乙酸钠和水;
D.滴加氨水至过量,得到银氨溶液;
解答 解:A.用铜电极电解CuSO4溶液,离子方程式:Cu+2H20$\frac{\underline{\;通电\;}}{\;}$Cu2++4H++O2↑,故A错误;
B.惰性电极电解MgCl2溶液,阳极是氯离子放电生成氯气,阴极是溶液中氢离子放电生成氢气,溶液中氢氧根离子结合镁离子生成氢氧化镁沉淀,Mg2++2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Mg(OH)2↓+Cl2↑+H2↑,故B错误;
C.乙醛溶液中加入新制碱性Cu(OH)2悬浊液并加热生成红色沉淀氧化亚铜,乙酸和水,反应离子方程式为:CH3CHO+2 Cu(OH)2+OH-$\stackrel{△}{→}$ CH3COO-+Cu2O↓+3H2O,故C正确;
D.滴加氨水至过量,得到银氨溶液,离子反应为Ag++2NH3•H2O=Ag(NH3)2++2H2O,故答案为:Ag++2NH3•H2O=Ag(NH3)2++2H2O,故D错误;
故选C.
点评 本题考查了电解原理、电解产物判断、物质性质和离子方程式书写等,掌握基础是解题关键,题目难度中等.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
2.下列实验可达到实验目的是( )
| A. | 将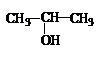 与NaOH的水溶液共热制备CH3-CH═CH2 与NaOH的水溶液共热制备CH3-CH═CH2 | |
| B. | 用甲苯与稀硝酸、稀硫酸的混合酸相混制取TNT | |
| C. | 甲苯在溴化铁催化作用下与液溴反应生成2,4,6-三溴甲苯 | |
| D. | 向CH3CH2Br中滴入AgNO3溶液就可以检验溴元素 |
9.(1)次磷酸(H3PO2)是一种一元中强酸,重要的精细化工产品.
①写出次磷酸的电离方程式:H3PO2?H++H2PO2-.
②已知某温度下0.01mol/L的NaOH溶液pH=10,将该NaOH溶液与等浓度等体积的H3PO2溶液混合,混合后溶液pH=7,则此时c(OH-)-c(H3PO2)=10-7mol/L.(用具体数值表示)
(2)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如表,
上述盐溶液中的阴离子,结合H+能力最强的是CO32-.根据表中数据,浓度均为0.01mol•L-1的下列四种酸的溶液分别稀释100倍,PH变化最大的是C(填编号).
A.HCN B.HClO C.CH3COOH D.H2CO3.
①写出次磷酸的电离方程式:H3PO2?H++H2PO2-.
②已知某温度下0.01mol/L的NaOH溶液pH=10,将该NaOH溶液与等浓度等体积的H3PO2溶液混合,混合后溶液pH=7,则此时c(OH-)-c(H3PO2)=10-7mol/L.(用具体数值表示)
(2)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如表,
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| PH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCN B.HClO C.CH3COOH D.H2CO3.
6.现代居室空气污染,主要来源是化纤地毯、装饰材料、油漆家俱等释放出的主要污染物是( )
| A. | CH4 | B. | CO | C. | CO2 | D. | HCHO |
7.下列有关表述不正确的是( )
| A. | 向氯水中加入Na2CO3粉末有气体产生 | |
| B. | 用强光照射装满次氯酸的试管(倒置于水槽中)可收集到两种气体 | |
| C. | 漂白粉和次氯酸溶液都是混合物 | |
| D. | 向漂白粉中加入浓盐酸可能产生黄绿色气体 |
