题目内容
5. A、B、C、D、E、F、G七种物质间存在如图所示转化关系,其中A、B、D、G含有同种元素.已知:A为金属单质,C为黄绿色气体;D能将某种非金属氧化物氧化为F,F是含有三种元素的化合物.请回答下列问题:
A、B、C、D、E、F、G七种物质间存在如图所示转化关系,其中A、B、D、G含有同种元素.已知:A为金属单质,C为黄绿色气体;D能将某种非金属氧化物氧化为F,F是含有三种元素的化合物.请回答下列问题:(1)以上反应中属于化合反应的是①⑦ (填序号).
(2)G生成B的过程中所出现的现象生成的白色沉淀在空气中迅速变化为灰绿色最后变化为红褐色.
(3)反应⑦的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)反应③的离子方程式2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(5)D的水溶液显酸性,请用离子方程式解释原因Fe3++3H2O?Fe(OH)3+3H+.
分析 C为黄绿色气体,C为Cl2,其中A、B、D、G含有同种元素,已知:A为金属单质,结合变化过程分析A为变价金属判断A为Fe,所以D是氯化铁,D能将某种氧化物氧化为F,说明该氧化物具有还原性,所以该氧化物是二氧化硫,二氧化硫和氯化铁反应生成硫酸,F是含有三种元素的化合物,所以F是硫酸,则G是硫酸亚铁,E为H2,根据反应④⑥可知I为氯化亚铁,B为氢氧化铁,H为氢氧化钠,上述分析可知A为Fe,B为Fe(OH)3,C为Cl2,D为FeCl3,E为H2,F为H2SO4,G为FeSO4,I为Fe(OH)2,H为NaOH,
(1)反应中化合反应是两种或两种以上的物质反应生成一种物质的反应为化合反应;
(2)G生成B的过程反应是硫酸亚铁和氢氧化钠生成白色氢氧化亚铁,在空气中迅速变化为灰绿色最后变化为红褐色;
(3)反应⑦是氢氧化亚铁被空气中氧气氧化为氢氧化铁;
(4)反应③为D为FeCl3和二氧化硫反应生成硫酸和氯化亚铁的反应;
(5)D为FeCl3,溶液中铁离子水解溶液显酸性.
解答 解:C为黄绿色气体,C为Cl2,其中A、B、D、G含有同种元素,已知:A为金属单质,结合变化过程分析A为变价金属判断A为Fe,所以D是氯化铁,D能将某种氧化物氧化为F,说明该氧化物具有还原性,所以该氧化物是二氧化硫,二氧化硫和氯化铁反应生成硫酸,F是含有三种元素的化合物,所以F是硫酸,则G是硫酸亚铁,E为H2,根据反应④⑥可知I为氯化亚铁,B为氢氧化铁,H为氢氧化钠,上述分析可知A为Fe,B为Fe(OH)3,C为Cl2,D为FeCl3,E为H2,F为H2SO4,G为FeSO4,I为Fe(OH)2,H为NaOH,
(1)反应中化合反应是两种或两种以上的物质反应生成一种物质的反应为化合反应,反应①为2Fe+3Cl2=2FeCl3,反应⑦为4Fe(OH)2+O2+2H2O=4Fe(OH)3,①⑦属于化合反应,故答案为:①⑦;
(2)G生成B的过程反应是硫酸亚铁和氢氧化钠生成白色氢氧化亚铁,反应为FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,4Fe(OH)2+O2+2H2O=4Fe(OH)3,现象为:生成的白色沉淀在空气中迅速变化为灰绿色最后变化为红褐色,
故答案为:生成的白色沉淀在空气中迅速变化为灰绿色最后变化为红褐色;
(3)反应⑦是氢氧化亚铁被空气中氧气氧化为氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)反应③为D为FeCl3和二氧化硫反应生成硫酸和氯化亚铁的反应,反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(5)D为FeCl3,溶液中铁离子水解溶液显酸性,反应的离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,
故答案为:酸;Fe3++3H2O?Fe(OH)3+3H+.
点评 本题以物质推断为载体考查了元素化合物的性质,金属单质为变价金属元素为题眼来正确推断物质是解本题的关键,注意铁离子能把二氧化硫氧化呈硫酸不是三氧化硫,题目难度中等.

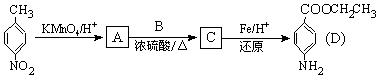
①太阳光催化分解水制氢:2H2O(1)=2H2(g)+O2(g)△H1=+571.6kJ•mol-1
②焦炭与水反应制氢:C(g)+H2O(g)=CO(g)+H2(g)△H2=+13.13kJ•mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.2kJ•mol-1
下列说法正确的是( )
| A. | 反应中电能转化为化学能 | |
| B. | 反应低温可以自发转化 | |
| C. | 上述反应若使用催化剂,能改变反应的△H | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H=74.8kJ•mol-1 |
(硫有-2、+4、+6价)
| A. | 硫单质有氧化性 | B. | 二氧化硫具有还原性 | ||
| C. | 硫酸可以被氧化 | D. | 硫化氢(H2S)可以被氧化 |
| A. | Na和O2 | B. | Cu和HNO3 | C. | Na2O2和CO2 | D. | AlCl3和NaOH |
| A. | 银白色金属 | B. | 不与氧气反应 | ||
| C. | 能发生铝热反应 | D. | 能与氢氧化钠溶液反应 |
| A. | ④③①②⑤ | B. | ④⑤③②① | C. | ④③②①⑤ | D. | ④②③①⑤ |
 、BCH3CH2OH、C
、BCH3CH2OH、C .
.
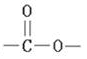
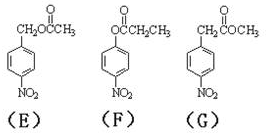
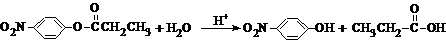 .
.

 的流程图(无机试剂任选).合成路线流程图示如图:
的流程图(无机试剂任选).合成路线流程图示如图: