题目内容
下列说法中不正确的是( )
| A、新制氯水可使紫色石蕊试液先变红后褪色 |
| B、漂白粉的有效成分为Ca(ClO)2和CaCl2 |
| C、液氯和氯水的成分不同 |
| D、干燥的氯气可以保存在钢瓶中 |
考点:氯、溴、碘及其化合物的综合应用
专题:卤族元素
分析:A.新制氯水中含有盐酸和次氯酸;
B.漂白粉的有效成分为Ca(ClO)2;
C.氯水为混合物;
D.干燥的氯气与铁不反应.
B.漂白粉的有效成分为Ca(ClO)2;
C.氯水为混合物;
D.干燥的氯气与铁不反应.
解答:
解:A.新制氯水中含有盐酸和次氯酸,盐酸可使石蕊试液变红,次氯酸具有漂白性,可使试液褪色,故A正确;
B.漂白粉的主要成分为Ca(ClO)2和CaCl2,有效成分为Ca(ClO)2,故B错误;
C.液氯为纯净物,氯水为混合物,含有水、氯气、HCl、HClO等,故C正确;
D.干燥的氯气与铁不反应,故D正确.
故选B.
B.漂白粉的主要成分为Ca(ClO)2和CaCl2,有效成分为Ca(ClO)2,故B错误;
C.液氯为纯净物,氯水为混合物,含有水、氯气、HCl、HClO等,故C正确;
D.干燥的氯气与铁不反应,故D正确.
故选B.
点评:本题考查氯气、含氯化合物等知识,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,主要相关基础知识的积累,难度不大.

练习册系列答案
相关题目
用价层电子对互斥理论预测H2S和NH3的立体结构,两个结论都正确的是( )
| A、直线形;三角锥形 |
| B、V形;三角锥形 |
| C、直线形;平面三角形 |
| D、V形;平面三角形 |
已知-CN中形成碳氮三键,下列有机分子中,所有的原子不可能处于同一平面的是( )
A、 |
B、 |
| C、CH2=C(CH3)-CH=CH2 |
| D、CH2=CH-CN |
下列叙述正确的是( )
| A、Na2CO3和NaHCO3的混合溶液中一定存在:c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-) |
| B、1mol Cl2通入含1mol FeBr2的溶液中发生反应的离子方程式:Cl2+2Br-=2Cl-+Br2 |
| C、能使甲基橙显红色的溶液中大量存在:Mg2+、I-、Cl-、NO3- |
| D、从C(石墨)=C(金刚石)△H=+1.9kJ?mol-1,可知金刚石比石墨更稳定 |
有机物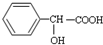 有多种同分异构体,其中符合属于酯类且能与氯化铁溶液发生显色反应的同分异构体有多少种(不考虑立体异构)( )
有多种同分异构体,其中符合属于酯类且能与氯化铁溶液发生显色反应的同分异构体有多少种(不考虑立体异构)( )
 有多种同分异构体,其中符合属于酯类且能与氯化铁溶液发生显色反应的同分异构体有多少种(不考虑立体异构)( )
有多种同分异构体,其中符合属于酯类且能与氯化铁溶液发生显色反应的同分异构体有多少种(不考虑立体异构)( )| A、6 种 |
| B、9 种 |
| C、15 种 |
| D、19 种 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、11.2L氯气含有的分子数为0.5NA |
| B、32g氧气中所含有的氧原子数为2NA |
| C、2.4g镁变成镁离子,转移的电子数为0.1NA |
| D、1L 0.3mol/L K2SO4溶液中含有的K+数为0.3NA |
 控制适合的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池(盐桥起到导电作用).下列判断不正确的是( )
控制适合的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池(盐桥起到导电作用).下列判断不正确的是( )| A、反应开始时,乙中石墨电极上发生氧化反应 |
| B、反应开始时,甲中石墨电极作负极 |
| C、电流计读数为零时,反应达到化学平衡状态 |
| D、电流计读数为零后,在甲中溶入FeCl2,电流表可能会再次产生偏转 |
 托盘天平、容量瓶、滴定管、量筒是中学化学常见的计量仪器,熟知这些仪器的使用是定量研究化学的基础.
托盘天平、容量瓶、滴定管、量筒是中学化学常见的计量仪器,熟知这些仪器的使用是定量研究化学的基础.