题目内容
16.过氧化氢H2O2,(氧的化合价为-1价),水溶液俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.对于下列A~F涉及H2O2的反应,回答相关问题:A.Na2O2+2HCl=2NaCl+H2O2B.2H2O2=2H2O+O2↑
C.Ag2O+H2O2=2Ag+O2↑+H2O D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O E.H2O2+MnSO4=MnO2+H2SO4F.H2O2+2Fe2++2H+═2Fe3++2H2O
(1)上述反应属于氧化还原反应的是(填代号)B、C、D、E、F.
(2)H2O2仅体现氧化性的反应是(填代号)D、E、F.
(3)H2O2仅体现还原性的反应是(填代号)C.
(4)上述反应说明H2O2、Ag2O、MnO2氧化性由强到弱的顺序是:Ag2O>H2O2>MnO2.
分析 (1)反应前后各元素化合价不变的化学反应是非氧化还原反应;
(2)反应前后双氧水中的元素得电子化合价降低,则双氧水体现氧化性;
(3)反应前后双氧水中的元素失电子化合价升高,则双氧水体现还原性;
(4)同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性.
解答 解:(1)反应前后各元素化合价不变的化学反应是非氧化还原反应,A中各元素在反应前后没有化合价的变化,所以是非氧化还原反应,B、C、D、E、F各步反应都涉及元素化合价的变化,都是氧化还原反应,故答案为:B、C、D、E、F;
(2)D、E、F中过氧化氢中的氧元素化合价降低,得电子发生还原反应,只具有氧化性,故答案为:D、E、F;
(3)C反应中过氧化氢中的氧元素化合价升高,失电子发生氧化反应,只具有还原性,故答案为:C;
(4)反应Ag2O+H2O2=2Ag+O2↑+H2O中,氧化银做氧化剂,双氧水作还原剂,则氧化性Ag2O>H2O2,反应H2O2+MnSO4=MnO2+H2SO4中,双氧水做氧化剂,MnO2做氧化产物,则氧化性H2O2>MnO2,故氧化性顺序为:Ag2O>H2O2>MnO2,故答案为:Ag2O>H2O2>MnO2.
点评 本题考查了氧化还原反应的有关知识,根据反应前后元素化合价的变化判断其氧化性、还原性即可,难度不大.

练习册系列答案
相关题目
6.下列说法错误的是( )
| A. | 从1L1mol•L-1的NaCl溶液中取出10mL,其浓度仍为1mol•L-1 | |
| B. | 配制0.5L1mol•L-1的盐酸,需要氯化氢气体11.2L(标准状况) | |
| C. | 将40gNaOH溶于1L水中,所得溶液的物质的量浓度为1mol/L | |
| D. | 0.5L2mol•L-1BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023 |
7.2015年12月12日,《联合国气候变化框架公约》近200个缔约方一致同意通过《巴黎协定》.指出各国应提高力度、加强国际合作,实现全球应对气候变化长期目标.下列做法与社会可持续发展理念相违背的是( )
| A. | 改进汽车尾气净化技术,减少大气污染物的排放 | |
| B. | 开发利用可再生能源,减少化石燃料的使用 | |
| C. | 研发可降解高分子材料,减少“白色污染冶 | |
| D. | 过度开采矿物资源,促进地方经济发展 |
4.下列关于 的说法中正确的是( )
的说法中正确的是( )
 的说法中正确的是( )
的说法中正确的是( )| A. | 所有碳原子都在同一平面上 | |
| B. | 最多只可能有9个碳原子在同一平面上 | |
| C. | 只可能有5个碳原子在同一直线上 | |
| D. | 可能有6个碳原子在同一直线上 |
11.有关分散系的下列说法不正确的是( )
| A. | 悬浊液的分散质可用过滤的方法从分散剂中分离出来 | |
| B. | 分散质粒子直径为1-100纳米的分散系是胶体 | |
| C. | 相同温度下同一种溶质的饱和溶液要比不饱和溶液的浓度大一些 | |
| D. | 任何物质在水中溶解都有一定的溶解度 |
1.下列说法正确的是( )
| A. | 氯水能导电,所以氯气是电解质 | |
| B. | CaCO3不溶于水,所以它是非电解质 | |
| C. | NaHCO3是强电解质,所以它的水溶液中不存在电离平衡 | |
| D. | 体积相同,c(OH-)相同的氨水和 NaOH 溶液被中和,前者消耗 HCl 多,所以NH3•H2O 是弱电解质 |
6.下列说法错误的是( )
| A. | 任何化学反应都有一定的限度,只是不同反应的限度不同罢了 | |
| B. | 化学反应的限度可通过改变条件而改变,如浓度、温度 | |
| C. | 可逆反应是指同一条件下,既可以向正反应方向进行,又可向逆反应方向进行的反应 | |
| D. | 当一个可逆反应进行到正反应速率与逆反应速率相等时,反应就停止了 |
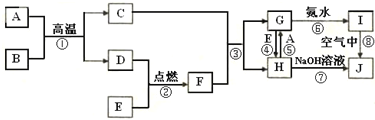
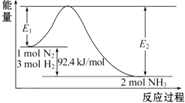 工业合成氨反应的能量变化如图所示.
工业合成氨反应的能量变化如图所示.