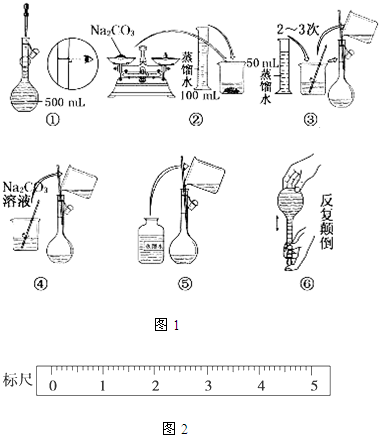
题目内容
如图表示常见元素单质及化合物相应关系,某些生成物略去.请回答下列问题:

已知:反应①为氯碱工业的基础反应;X、Y为常见金属,Z为形成酸雨的主要成分
(1)D的电子式 ;H为 (填化学式)
(2)完成下列方程式
ⅰ.空气中含量最高的气体与C反应的化学反应方程式 ;
ⅱ.反应②的化学反应方程式 ;
ⅲ.足量B通入H溶液的离子反应方程式 .

已知:反应①为氯碱工业的基础反应;X、Y为常见金属,Z为形成酸雨的主要成分
(1)D的电子式
(2)完成下列方程式
ⅰ.空气中含量最高的气体与C反应的化学反应方程式
ⅱ.反应②的化学反应方程式
ⅲ.足量B通入H溶液的离子反应方程式
考点:无机物的推断
专题:推断题
分析:反应①是氯碱工业的基础反应,应是电解饱和食盐水,得到B、C、D,D为NaOH溶液,X、Y为常见金属,能与B反应,则B为Cl2,C为H2,Y与F反应得到X与G,应为铝热反应,则X为Fe,G为Al2O3,可知Y为Al,E为FeCl3,F为Fe2O3,I为NaAlO2,Z为形成酸雨的主要成分,则Z为SO2,H为NaHSO3,以此解答该题.
解答:
解:反应①是氯碱工业的基础反应,应是电解饱和食盐水,得到B、C、D,D为NaOH溶液,X、Y为常见金属,能与B反应,则B为Cl2,C为H2,Y与F反应得到X与G,应为铝热反应,则X为Fe,G为Al2O3,可知Y为Al,E为FeCl3,F为Fe2O3,I为NaAlO2,Z为形成酸雨的主要成分,则Z为SO2,H为NaHSO3,
(1)D为NaOH,电子式为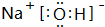 ;H为NaHSO3,
;H为NaHSO3,
故答案为: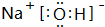 ;NaHSO3;
;NaHSO3;
(2)ⅰ.空气中含量最高的气体为氮气,与氢气反应的化学反应方程式:N2+3H2
2NH3,
故答案为:N2+3H2
2NH3;
ⅱ.反应②的化学反应方程式为:2Al+Fe2O3
2Fe+Al2O3 ,
故答案为:2Al+Fe2O3
2Fe+Al2O3 ;
ⅲ.足量氯气通入NaHSO3溶液的离子反应方程式为:Cl2+HSO3-=2Cl-+SO42-+3H+,
故答案为:Cl2+HSO3-=2Cl-+SO42-+3H+.
(1)D为NaOH,电子式为
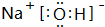 ;H为NaHSO3,
;H为NaHSO3,故答案为:
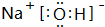 ;NaHSO3;
;NaHSO3;(2)ⅰ.空气中含量最高的气体为氮气,与氢气反应的化学反应方程式:N2+3H2
| ||
| 高温高压 |
故答案为:N2+3H2
| ||
| 高温高压 |
ⅱ.反应②的化学反应方程式为:2Al+Fe2O3
| ||
故答案为:2Al+Fe2O3
| ||
ⅲ.足量氯气通入NaHSO3溶液的离子反应方程式为:Cl2+HSO3-=2Cl-+SO42-+3H+,
故答案为:Cl2+HSO3-=2Cl-+SO42-+3H+.
点评:本题考查无机物推断,反应①为氯碱工业基础、Z为形成酸雨的主要成分、转化关系中铝热反应等是推断突破口,题目比较综合,需要学生熟练掌握基础知识知识,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关说法正确的是( )
| A、AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 |
| B、反应Hg(1)+H2SO4(aq)=HgSO4(aq)+H2(g)在常温下不能自发进行,则△H>0 |
| C、将纯水加热至较高温度,K变大、pH变小、呈酸性 |
| D、锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 |
下列除杂或者分离方法不正确的是( )
| A、除去乙酸乙酯中少量乙酸:加入饱和苏打溶液,振荡、静置分层后分液 |
| B、除去苯中少量苯酚:加入溴水,振荡后过滤 |
| C、除去SO2中的少量CO2:通过澄清石灰水 |
| D、提取溶解在水中的少量溴:加入苯,振荡、静置分层后,分液后取有机层进行蒸馏 |
13g锌与硝酸溶液反应,共消耗了31.5g硝酸,则硝酸的还原产物是( )
| A、只有N2O |
| B、NH4NO3或N2O |
| C、只有NO |
| D、只有N2 |