题目内容
2011年7月19日,美国能源部西北太平洋国家实验室的科学家和来自中国武汉大学访问学者组成的研究小组合作开发钠离子充电电池,研究人员采用廉价的钠离子同时使用纳米二氧化锰和锂材料作电极制作出了钠离子充电电池,其工作示意图如图所示.
回答:
(1)Na+向 极移动(填A或B),A极作 极(填正或负),充电时外加直流电源的正极和该原电池的 极相连(填A或B).
(2)为体现节能减排的理念,中国研制出了新型燃料电池汽车,该车装有“绿色心脏”--质子交换膜燃料电池.右图是某种质子交换膜燃料电池原理示意图.该电池的正极是 (填“a”或“b”,下同)极,写出该电池的负极反应式为:
(3)最近,德州市开工建设大型太阳能电池板材料生产基地,这种材料主要是高纯度的硅,下面关于硅的叙述中,正确的是 .
A.硅单质用于制造光导纤维
B.SiO2是酸性氧化物,它不溶于任何酸
C.SiO2与碳酸钠固体高温条件下反应,说明硅酸的酸性强于碳酸
D.硅的化学性质不活泼,地壳中含量在所有的元素中居第二位,在自然界中以化合态存在

回答:
(1)Na+向
(2)为体现节能减排的理念,中国研制出了新型燃料电池汽车,该车装有“绿色心脏”--质子交换膜燃料电池.右图是某种质子交换膜燃料电池原理示意图.该电池的正极是
(3)最近,德州市开工建设大型太阳能电池板材料生产基地,这种材料主要是高纯度的硅,下面关于硅的叙述中,正确的是
A.硅单质用于制造光导纤维
B.SiO2是酸性氧化物,它不溶于任何酸
C.SiO2与碳酸钠固体高温条件下反应,说明硅酸的酸性强于碳酸
D.硅的化学性质不活泼,地壳中含量在所有的元素中居第二位,在自然界中以化合态存在

考点:化学电源新型电池
专题:电化学专题
分析:(1)原电池中电子从负极流向正极,溶液中阳离子向正极移动;充电时外加直流电源的正极和该原电池的正极相连;
(2)燃料电池中通入氧气的一极为正极,通燃料的一极为负极;氢气在负极失电子生成氢离子;
(3)A.硅单质是半导体材料;
B.SiO2能与氢氟酸反应;
C.硅酸的酸性弱于碳酸;
D.硅属于亲氧元素,在自然界中以化合态存在.
(2)燃料电池中通入氧气的一极为正极,通燃料的一极为负极;氢气在负极失电子生成氢离子;
(3)A.硅单质是半导体材料;
B.SiO2能与氢氟酸反应;
C.硅酸的酸性弱于碳酸;
D.硅属于亲氧元素,在自然界中以化合态存在.
解答:
解:(1)原电池中电子从负极流向正极,由图中电子流向可知,A为负极,B为正极;溶液中阳离子向正极移动,则Na+向B极移动;充电时外加直流电源的正极和该原电池的正极相连,即与B相连;
故答案为:B;负;B;
(2)燃料电池中通入氧气的一极为正极,通燃料的一极为负极,则该电池的正极是b极;氢气在负极失电子生成氢离子,则负极的电极反应式为:H2-2e-=2H+;
故答案为:b;H2-2e-=2H+;
(3)A.硅单质是半导体材料,二氧化硅晶体能用于制造光导纤维,故A错误;
B.SiO2是酸性氧化物,但是能与氢氟酸反应,故B错误;
C.碳酸与硅酸钠反应生成硅酸,则硅酸的酸性弱于碳酸,故C错误;
D.硅的化学性质不活泼,地壳中含量在所有的元素中居第二位,硅属于亲氧元素,在自然界中以化合态存在,故D正确;
故答案为:D.
故答案为:B;负;B;
(2)燃料电池中通入氧气的一极为正极,通燃料的一极为负极,则该电池的正极是b极;氢气在负极失电子生成氢离子,则负极的电极反应式为:H2-2e-=2H+;
故答案为:b;H2-2e-=2H+;
(3)A.硅单质是半导体材料,二氧化硅晶体能用于制造光导纤维,故A错误;
B.SiO2是酸性氧化物,但是能与氢氟酸反应,故B错误;
C.碳酸与硅酸钠反应生成硅酸,则硅酸的酸性弱于碳酸,故C错误;
D.硅的化学性质不活泼,地壳中含量在所有的元素中居第二位,硅属于亲氧元素,在自然界中以化合态存在,故D正确;
故答案为:D.
点评:本题考查了原电池和电解池原理、硅及其化合物的性质和用途等知识点,明确原电池正负极的判断方法、电极反应式是解本题关键,难度中等.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
下列说法正确的是( )
| A、2-二甲基-2-溴丁烷发生消去反应后的生成物不存在同分异构体 |
| B、在CH3-CH=CH-C≡C-CF3分子中,6个碳原子一定不在同一平面上 |
| C、由2-氯丙烷制取1,2-丙二醇时,需要经过取代→消去→加成三步反应完成 |
| D、将铜丝在酒精灯火焰上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
下列物质间的转化关系中,M不能为( )
M
氧化物
酸或碱
盐.
M
| O2 |
| H2O |
| +NaOH或HCl |
| A、钠 | B、氮气 | C、木炭 | D、硫 |
在由水电离出的C[OH-]=1×10-13mol/L的溶液中,能大量共存的离子组是( )
| A、Fe2+ Na+ NO3- Cl- |
| B、Ba2+ Na+ NO3- Cl- |
| C、SO42- SO32- NH4+ Na+ |
| D、Mg2+ Na+ Br- ClO- |
某校活动小组为探究金属腐蚀的相关原理,设计了如图a所示装置,图a的铁棒末段分别连上一块Zn片和Cu片,并静置于含有K3Fe(CN)6及酚酞的混合凝胶上.一段时间后发现凝胶的某些区域(如图b示)发生了变化,已知Fe2+可用K3Fe(CN)6来检验(呈蓝色).则下列说法不正确的是( )


| A、甲区呈现红色 |
| B、乙区产生Zn2+ |
| C、丙区发生的电极反应式:Cu-2e-=Cu2+ |
| D、丁区呈现蓝色 |
铝片与盐酸的反应属于( )
| A、吸热反应 |
| B、放热反应 |
| C、氧化还原反应 |
| D、非氧化还原反应 |
14 6 |
14 6 |
| A、质子数为14 |
| B、中子数为6 |
| C、电子数为6 |
| D、质量数为8 |
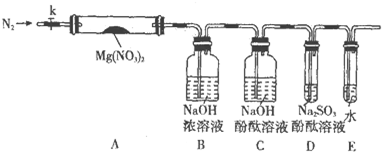 固体硝酸盐加热易分解且产物较复杂.已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐的热分解反应方程式如下:
固体硝酸盐加热易分解且产物较复杂.已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐的热分解反应方程式如下: