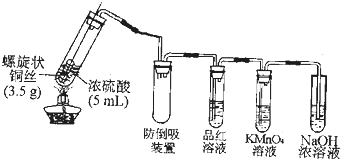
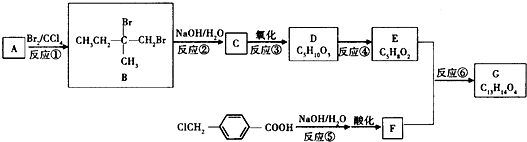
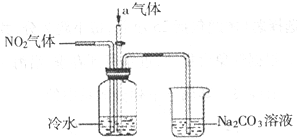
题目内容
在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g)△H=a kJ?mol-1(a>0),该温度下K=0.263,下列有关该反应的说法正确的是( )
| A、达到化学平衡状态时,若c(CO)=0.100 mol?L-1,则c(CO2)=0.0263 mol?L-1 |
| B、若要提高CO的转化率,则应该加入适当的过量FeO |
| C、升高温度混合气体的平均相对分子质量不变 |
| D、若生成56gFe,则吸收的热量小于a kJ |
考点:化学平衡的计算
专题:
分析:A、根据平衡常数进行相应的计算来判断;
B、在化学平衡中,固体量的增减不会影响化学反应速率的改变和化学平衡的移动;
C、升高温度,平衡右移,气体质量增大;
D、由热化学方程式的意义可知,生成1molFe,吸收的热量等于akJ.
B、在化学平衡中,固体量的增减不会影响化学反应速率的改变和化学平衡的移动;
C、升高温度,平衡右移,气体质量增大;
D、由热化学方程式的意义可知,生成1molFe,吸收的热量等于akJ.
解答:
解:A、该温度下K=
=0.263,若c(CO)═0.100mol/L,由平衡常数可知c(CO2)=0.1mol/L×0.263═0.0263mol/L,故A正确;
B、加入适当的过量FeO,不会影响化学反应速率的改变和化学平衡的移动,CO的转化率不会改变,故B错误;
C、升高温度,平衡右移,故混合气体的质量变大,混合气体的物质的量不变,故混合气体的平均相对分子质量变大,故C错误;
D、由热化学方程式的意义可知,生成1molFe,吸收的热量等于akJ,故D错误.
故选A.
| c(CO2) |
| c(CO) |
B、加入适当的过量FeO,不会影响化学反应速率的改变和化学平衡的移动,CO的转化率不会改变,故B错误;
C、升高温度,平衡右移,故混合气体的质量变大,混合气体的物质的量不变,故混合气体的平均相对分子质量变大,故C错误;
D、由热化学方程式的意义可知,生成1molFe,吸收的热量等于akJ,故D错误.
故选A.
点评:本题主要考查的是热化学方程式、化学平衡的影响因素、平衡状态的判断、平衡常数的有关计算等,难度中等,注意C选项中平衡状态的判断,选择判断的物理量随反应进行发生变,当该物理量不再变化,说明到达平衡.

练习册系列答案
相关题目
下列离子方程式中正确的是( )
| A、向Ca(OH)2溶液中滴入少量NaHCO3溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| B、向H2SO4溶液中滴入少量Ba(OH)2溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| C、向NaOH溶液中通入足量的CO2:CO2+OH-═HCO3- |
| D、向Fe2(SO4)3溶液中滴入足量的氨水:Fe3++3OH-═Fe(OH)3↓ |
下列离子方程式正确的是( )
| A、向Fe(NO3)3溶液中滴入少量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| B、向苯酚钠溶液中通入少量CO2气体:2C6H5O-+CO2+H2O-→2C6H5OH↓+CO32- |
| C、Cu(OH)2沉淀溶于氨水得到深蓝色溶液:Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH- |
| D、澄清石灰水中加入少量NaHCO3溶液:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
下列叙述正确的是( )
| A、饱和石灰水中加入少量CaO,恢复至室温后溶液的pH不变 |
| B、稀醋酸加水稀释,醋酸电离程度增大,溶液pH减小 |
| C、盐酸中滴加氨水呈中性,溶液中的溶质为氯化铵 |
| D、向沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 |