题目内容
25℃时,溶液只含有Na+、H+、OH-、CH3COO-这四种离子,下列说法错误的是( )
| A、溶液只能是CH3COONa溶液 |
| B、溶液中的离子浓度可能是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C、溶液中的离子浓度可能是c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D、溶液中的离子浓度可能是c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
考点:离子浓度大小的比较
专题:
分析:A.从溶液电荷守恒的角度分析;
B.溶液呈酸性,应存在c(CH3COO-)>c(Na+);
C.CH3COONa为强碱弱酸盐,溶液呈碱性;
D.如NaOH过量,则可存在题中关系.
B.溶液呈酸性,应存在c(CH3COO-)>c(Na+);
C.CH3COONa为强碱弱酸盐,溶液呈碱性;
D.如NaOH过量,则可存在题中关系.
解答:
解:A.根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),溶液中溶质可能是CH3COONa溶液,或CH3COOH和CH3COONa的混合溶液,或CH3COONa和NaOH,故A错误;
B.c(H+)>c(OH-),说明溶液呈酸性,因醋酸为弱酸,则醋酸过量,应存在,c(CH3COO-)>c(Na+),溶液中的离子浓度可能是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B正确;
C.若溶质是CH3COONa,CH3COONa为强碱弱酸盐,溶液呈碱性,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C正确;
D.若是NaOH和CH3COONa作溶质,NaOH过量,可存在c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故D正确;
故选A.
B.c(H+)>c(OH-),说明溶液呈酸性,因醋酸为弱酸,则醋酸过量,应存在,c(CH3COO-)>c(Na+),溶液中的离子浓度可能是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B正确;
C.若溶质是CH3COONa,CH3COONa为强碱弱酸盐,溶液呈碱性,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C正确;
D.若是NaOH和CH3COONa作溶质,NaOH过量,可存在c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故D正确;
故选A.
点评:本题考查离子浓度的大小比较,题目难度中等,解答本题注意结合电荷守恒,把握弱电解质的电离和盐类水解的特点,能够根据离子浓度大小关系判断溶液的溶质,为解答该题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 国庆节期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )
国庆节期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )| A、其分子式为C15H21O4 |
| B、该有机物能发生取代、加成和水解反应 |
| C、1mol的该有机物与足量的钠反应产生1molH2 |
| D、该有机物不能使酸性KMnO4溶液褪色 |
美国科学家最近发明了利用眼泪来检测糖尿病的装置,其原理是利用氯金酸钠(NaAuCl4)溶液与眼泪中的葡萄糖反应生成纳米金单质颗粒(直径为20nm~60nm),下列说法中错误的是( )
| A、葡萄糖具有还原性 |
| B、葡萄糖的结构简式CH2OH(CHOH)4CHO |
| C、检测时NaAuCl4发生氧化反应 |
| D、纳米金单质颗粒分散在水中所得的分散系能产生丁达尔效应 |
香兰素是重要的香料之一,它可由丁香酚经多步反应合成,有关上述两种化合物的说法正确的是( )
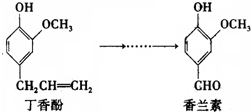

| A、香兰素分子中至少有12个原子共平面 |
| B、丁香酚不能与三氯化铁溶液发生显色反应 |
| C、1mol香兰素最多能与3mol氢气发生加成反应 |
| D、常温下1mol丁香酚只能与1molBr2反应 |
下列各组离子在溶液中能大量共存的是( )
| A、Na+、OH-、S2O32-、Cl- |
| B、Fe2+、K+、[Fe(CN)6]3-、NO3- |
| C、H+、C2O42-、MnO4-、SO42- |
| D、Na+、Ca2+、AlO2-、HCO3- |
设NA代表阿伏加德罗常数,下列说法中正确的是( )
| A、7.1gCl2与足量的铁反应转移电子数目为0.3NA |
| B、17g甲基(-14CH3)中含有的质子数为8NA |
| C、48gO2和O3的混合物含有的原子数为3NA |
| D、100mL0.5 mol/L 的乙酸溶液中分子总数小于0.05NA |






