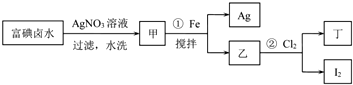
题目内容
5.下列有关实验操作、现象和解释或结论都正确的是( )| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向某溶液中先滴加氯水,再滴加少量KSCN溶液 | 溶液变成血红色 | 溶液中含有Fe2+ |
| B | AgCl沉淀中滴入稀KI溶液 | 有黄色沉淀出现 | AgI比AgCl更难溶 |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 淀粉与稀H2SO4共热,再加银氨溶液水浴加热 | 无银镜生成 | 淀粉水解产物无还原性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.滴加试剂顺序错误;
B.发生沉淀的转化;
C.铝溶于稀硝酸;
D.银镜反应应在碱性条件下进行.
解答 解:A.滴加试剂顺序错误,应先加KSCN,如无现象,再滴加氯水,如溶液变为红色,可说明含有亚铁离子,故A错误;
B.AgCl沉淀中滴入稀KI溶液有黄色沉淀出现,发生沉淀的转化,所以Ksp(AgI)<Ksp(AgCl),故B正确;
C.铝与浓硝酸发生钝化反应,但溶于稀硝酸,故C错误;
D.银镜反应应在碱性条件下进行,题中没有加入碱调节溶液pH,故D错误.
故选B.
点评 本题考查化学实验方案的评价,涉及物质的检验、沉淀转化等知识,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型和高频考点,注意把握实验的严密性和合理性,难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
15.下列有机反应类型的判断不正确的是( )
| A. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑(取代反应) | |
| B. | CH2═CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH(加成反应) | |
| C. | CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O(取代反应) | |
| D. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O(加成反应) |
13.用铝土矿(杂质为SiO2、Fe2O3等)为原料冶炼铝的流程如下(其中料液b呈碱性),下列说法中正确的是( )


| A. | 反应Ⅰ的离子方程式为2OH-+Al2O3═2AlO2-+H2O | |
| B. | 操作a的内容包括:通入过量CO2、过滤、洗涤、灼烧 | |
| C. | 操作b为电解熔融状态的Al2O3或用CO还原Al2O3 | |
| D. | 固体b灼烧后与铝反应可用于工业上冶炼相应的金属 |
20.自从1902年德国化学家哈伯研究出合成氨的方法以来,氮的固定的相关研究获得了不断的发展.
(1)下表列举了不同温度下大气固氮的部分平衡常数K值.
①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.
②2260℃时,向2L密闭容器中充入0.3molN2和0.3molO2,模拟大气固氮反应,达到平衡时,N2的转化率是33.3%(结果保留三位有效数字).
(2)工业固氮的主要形式是:N2 (g)+3H2 (g)=2NH3 (g)△H<0,如图是当反应器中按n(N2):n(H2)=1:3 投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线.
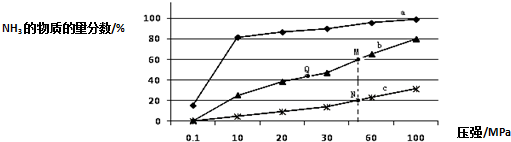
①曲线a对应的温度是200℃.
②关于工业合成氨的反应,下列叙述正确的是A(填字母).
A.图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
B.工业合成氨之后所以加入催化剂,是因为加入催化剂有利于提高反应的活化能
C.相同压强下,投料相同,达到平衡所需时间关系为c>b>a
③N点时c(NH3)=0.2mol/L,N点的化学平衡常数K=0.93(结果保留两位小数).
(3)合成氨原料气中的氢气可用天然气(主要成分为CH4)在高温、催化剂作用下与水蒸气反应制得,反应中每生成2mol CO2吸收316kJ热量,该反应的热化学方程式是CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+158kJ/mol,该方法制得的原料气中主要杂质是CO2,若用K2CO3溶液吸收,该反应的离子方程式是CO32-+CO2+H2O=2HCO3-.
(4)合成氨工业中含氨废水的处理方法之一是电化学氧化法,将含氨的碱性废水通入电解系统后,在阳极上氨被氧化成氮气而脱除,阳极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
(1)下表列举了不同温度下大气固氮的部分平衡常数K值.
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | |
| 温度/℃ | 27 | 2260 |
| K | 3.84×10-31 | 1 |
②2260℃时,向2L密闭容器中充入0.3molN2和0.3molO2,模拟大气固氮反应,达到平衡时,N2的转化率是33.3%(结果保留三位有效数字).
(2)工业固氮的主要形式是:N2 (g)+3H2 (g)=2NH3 (g)△H<0,如图是当反应器中按n(N2):n(H2)=1:3 投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线.

①曲线a对应的温度是200℃.
②关于工业合成氨的反应,下列叙述正确的是A(填字母).
A.图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
B.工业合成氨之后所以加入催化剂,是因为加入催化剂有利于提高反应的活化能
C.相同压强下,投料相同,达到平衡所需时间关系为c>b>a
③N点时c(NH3)=0.2mol/L,N点的化学平衡常数K=0.93(结果保留两位小数).
(3)合成氨原料气中的氢气可用天然气(主要成分为CH4)在高温、催化剂作用下与水蒸气反应制得,反应中每生成2mol CO2吸收316kJ热量,该反应的热化学方程式是CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+158kJ/mol,该方法制得的原料气中主要杂质是CO2,若用K2CO3溶液吸收,该反应的离子方程式是CO32-+CO2+H2O=2HCO3-.
(4)合成氨工业中含氨废水的处理方法之一是电化学氧化法,将含氨的碱性废水通入电解系统后,在阳极上氨被氧化成氮气而脱除,阳极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
17.下列有关离子方程式书写或离子共存说法正确的是( )
| A. | 在0.1 mol/L Na2CO3溶液中:Al3+、NH4+、SO42-、NO3-一定能大量共存 | |
| B. | 常温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol/L的溶液中,下列离子一定能大量共存:K+、Cl-、Fe2+、NO3- | |
| C. | 清洗锅炉时先用纯碱溶液浸泡的主要原因:CaSO4(s)+CO32-(aq)?SO42-(aq)+CaCO3(s) | |
| D. | 向Al2(SO4)3溶液中加入少量Ba(OH)2溶液:Ba2++SO42-+Al3++3OH-═BaSO4↓+Al(OH)3↓ |
15.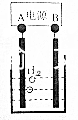 用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.
用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.
已知电解总反应为:2C6H13COONa+2CH3OH$\frac{\underline{\;通电\;}}{\;}$C12H26+2CO2↑+H2↑+2CH3ONa,
下列说法不正确的是( )
 用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.
用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.已知电解总反应为:2C6H13COONa+2CH3OH$\frac{\underline{\;通电\;}}{\;}$C12H26+2CO2↑+H2↑+2CH3ONa,
下列说法不正确的是( )
| A. | 图中电源的A极为直流电源的负极 | |
| B. | 加入金属钠可以将酸转化为钠盐,提高离子浓度,增强导电性 | |
| C. | 阳极电极反应为:2C6H13COO--2e-=C12H26+2CO2↑ | |
| D. | 反应一段时间后将电源正负极反接,会产生杂质影响正十二烷的制备 |
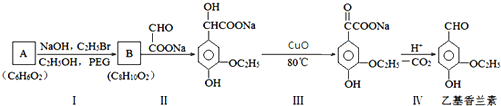
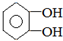 .
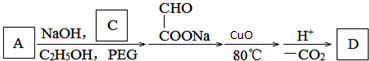
.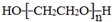 .若PEG的平均相对分子质量为17618,则其平均聚合度约为400.
.若PEG的平均相对分子质量为17618,则其平均聚合度约为400.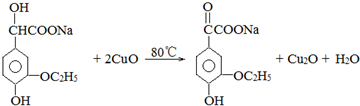 .
.
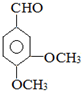 .
.