题目内容
15.下列分离提纯方法不正确的是( )| A. | 分离乙酸和乙酸乙酯,常用蒸馏法 | |
| B. | 提纯含有碘的氯化铵,常用升华法 | |
| C. | 除去碳酸钠中的少量碳酸氢钠,常用加热法 | |
| D. | 除去CO2中的SO2,通过盛有溴水的洗气瓶 |
分析 A.乙酸与乙酸乙酯的沸点不同;
B.升华时需要加热,氯化铵易分解;
C.碳酸氢钠不稳定,加热易分解;
D.二氧化硫可与溴发生氧化还原反应.
解答 解:A.乙酸与乙酸乙酯的沸点不同,可用蒸馏的方法分离,故A正确;
B.升华时需要加热,氯化铵易分解,冷却后碘和氯化铵都重新变为固体,不能分离,故B错误;
C.碳酸氢钠不稳定,加热易分解,可用加热的方法除杂,故C正确;
D.二氧化硫可与溴发生氧化还原反应,可用溴水除杂,故D正确.
故选B.
点评 本题考查物质的分离、提纯,侧重于物质的性质的考查,注意根据物质的性质的异同选择实验方法,题目难度不大.

练习册系列答案
相关题目
5.下列各组离子能在指定环境下大量共存的是( )
| A. | C(HCO3-)=0.1mol/L的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 室温下,PH=2的溶液中:Fe2+、SO42-、Na+、NO3- | |
| C. | 无色透明的溶液中:NH4+、Cl-、NO3-、Fe3+ | |
| D. | 使红色石蕊试纸变蓝的溶液中:SO32-、Na+、CO32-、K+ |
10.有100mL 3mol•L-1的NaOH溶液和100mL 1mol/L的AlCl3溶液,按如下两种方法进行实验:
①将NaOH溶液分多次加入到AlCl3溶液中(边加边搅拌);
②将AlCl3溶液分多次加入到NaOH溶液中(边加边搅拌).
比较两次实验的结果,其中正确的是( )
①将NaOH溶液分多次加入到AlCl3溶液中(边加边搅拌);
②将AlCl3溶液分多次加入到NaOH溶液中(边加边搅拌).
比较两次实验的结果,其中正确的是( )
| A. | 现象相同,沉淀量相等 | B. | 现象不同,沉淀量不等 | ||
| C. | 现象相同,沉淀量不等 | D. | 现象不同,沉淀量相等 |
20.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 氨水应密闭保存,放置于低温处 | |
| B. | 对2HI(g)?H2(g)+I2(g)平衡体系,增大平衡体系的压强可使气体颜色变深 | |
| C. | 生产硝酸的过程中使用过量空气以提高氨气的利用率 | |
| D. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 |
6.氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2═2SOCl2,部分装置如图所示,回答以下问题:
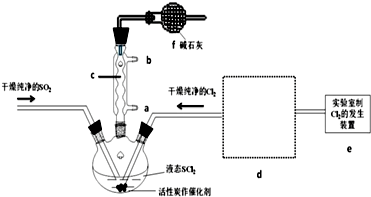
(1)仪器c的名称是球形冷凝管,装置f的作用是吸收逸出有毒的Cl2、SO2,防止空气中的水蒸气进入反应装置,防止SOCl2水解.
(2)实验室制Cl2的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)SOCl2与水反应的化学方程式为SOCl2+H2O=SO2↑+2HCl↑.蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3•6H2O混合加热,可得到无水AlCl3,试解释原因:AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解.
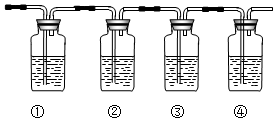
(4)下列四种制备SO2的方案中最佳选择是丁.
(5)装置e中产生的Cl2经过d后进入三颈烧瓶,请在d的虚线框内画出所需实验装置图,并标出试剂.
(6)试验结束后,将三颈烧瓶中混合物分离开的实验操作是蒸馏;(已知SCl2的沸点为50℃)若反应中消耗的Cl2的体积为896mL(已转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76g,则SOCl2的产率为50%(保留三位有效数字).

(1)仪器c的名称是球形冷凝管,装置f的作用是吸收逸出有毒的Cl2、SO2,防止空气中的水蒸气进入反应装置,防止SOCl2水解.
(2)实验室制Cl2的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)SOCl2与水反应的化学方程式为SOCl2+H2O=SO2↑+2HCl↑.蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3•6H2O混合加热,可得到无水AlCl3,试解释原因:AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解.
(4)下列四种制备SO2的方案中最佳选择是丁.
| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 | 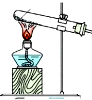 | 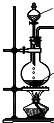 | 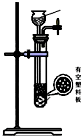 | 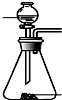 |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4 | 4mol/LHNO3+NaHSO3 | 70%NaHSO4+K2SO3 |
(6)试验结束后,将三颈烧瓶中混合物分离开的实验操作是蒸馏;(已知SCl2的沸点为50℃)若反应中消耗的Cl2的体积为896mL(已转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76g,则SOCl2的产率为50%(保留三位有效数字).
3.CO(g)+H2O(g)═H2(g)+CO2(g)△H<0,在其他条件不变的情况下( )
| A. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| B. | 反应物总能量小于生成物总能量 | |
| C. | 若在原电池中进行,反应放出的热量不变 | |
| D. | 升高温度,反应速率加快,但反应的△H不变 |
4.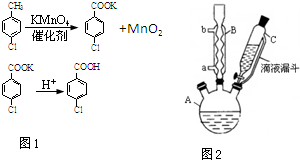 对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应(图1)、装置图如图2:
对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应(图1)、装置图如图2:
常温条件下的有关数据如下表所示:
实验步骤:在规格为250mL的装置A中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯;控制温度在93℃左右,反应2h,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩;然后过滤,将滤渣用冷水进行洗涤,干燥后称量其质量为7.19g.
请回答下列问题:
(1)装置B的名称是球形冷凝管.
(2)量取6.00mL对氯甲苯应选用的仪器是C.
A.10mL量筒 B.50mL容量瓶 C.50mL酸式滴定管 D.50mL碱式滴定管
(3)控制温度为93℃左右的方法是水浴加热.对氯甲苯的加入方法是逐滴加入而不是一次性加入,原因是减少对氯甲苯的挥发,提高原料利用率.
(4)第一次过滤的目的是除去MnO2,滤液中加入稀硫酸酸化,可观察到的实验现象产生白色沉淀.
(5)第二次过滤所得滤渣要用冷水进行洗涤,其原因是可除去对氯苯甲酸表面的可溶性杂质且尽量减小对氯苯甲酸的损耗.
(6)本实验的产率是D(填标号).
A.60% B.70% C.80% D.90%
 对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应(图1)、装置图如图2:
对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应(图1)、装置图如图2:常温条件下的有关数据如下表所示:
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 颜色 | 水溶性 | |
| 对氯甲苯 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
| 对氯苯甲酸 | 243 | 275 | 1.54 | 白色 | 微溶 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐 | ||||
请回答下列问题:
(1)装置B的名称是球形冷凝管.
(2)量取6.00mL对氯甲苯应选用的仪器是C.
A.10mL量筒 B.50mL容量瓶 C.50mL酸式滴定管 D.50mL碱式滴定管
(3)控制温度为93℃左右的方法是水浴加热.对氯甲苯的加入方法是逐滴加入而不是一次性加入,原因是减少对氯甲苯的挥发,提高原料利用率.
(4)第一次过滤的目的是除去MnO2,滤液中加入稀硫酸酸化,可观察到的实验现象产生白色沉淀.
(5)第二次过滤所得滤渣要用冷水进行洗涤,其原因是可除去对氯苯甲酸表面的可溶性杂质且尽量减小对氯苯甲酸的损耗.
(6)本实验的产率是D(填标号).
A.60% B.70% C.80% D.90%