题目内容
某铁矿废料是由Fe、Fe2O3、Al2O3、SiO2中的几种物质组成.为测定其中铁元素的含量,取20.0g样品进行如下实验:
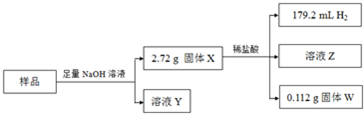
已知:向Z中滴加KSCN溶液,无明显现象;H2体积为标准状况下测得.请回答:
(1)分离X和Y的实验操作方法是 .
(2)向X中加入稀盐酸,发生氧化还原反应的离子方程式是 .
(3)下列说法正确的是 (填字母).
a.W能与稀盐酸反应
b.铁矿废料中一定含有Al2O3
c.向Z中滴加几滴氯水,溶液变黄
(4)经测定W为单质,则铁矿废料中铁元素的质量分数为 .

已知:向Z中滴加KSCN溶液,无明显现象;H2体积为标准状况下测得.请回答:
(1)分离X和Y的实验操作方法是
(2)向X中加入稀盐酸,发生氧化还原反应的离子方程式是
(3)下列说法正确的是
a.W能与稀盐酸反应
b.铁矿废料中一定含有Al2O3
c.向Z中滴加几滴氯水,溶液变黄
(4)经测定W为单质,则铁矿废料中铁元素的质量分数为
考点:探究物质的组成或测量物质的含量,铁的氧化物和氢氧化物
专题:实验题
分析:(1)根据分离固液混合物的操作分析;
(2)X固体中含有Fe、Fe2O3,根据二者与盐酸的反应分析;
(3)a.X固体中含有Fe、Fe2O3,加盐酸反应后剩余的固体W为Fe;
b.根据题中信息不能确定被氢氧化钠溶液溶解的物质;
c.溶液Z为氯化亚铁;
(4)设Fe2O3为xmol,Fe为ymol,根据氢气求出与盐酸反应的Fe,根据Fe2O3求出与Fe3+反应的Fe,在加上W的质量为Fe的质量,再加上Fe2O3中Fe的质量,则为Fe元素的总质量,再求出铁元素的质量分数.
(2)X固体中含有Fe、Fe2O3,根据二者与盐酸的反应分析;
(3)a.X固体中含有Fe、Fe2O3,加盐酸反应后剩余的固体W为Fe;
b.根据题中信息不能确定被氢氧化钠溶液溶解的物质;
c.溶液Z为氯化亚铁;
(4)设Fe2O3为xmol,Fe为ymol,根据氢气求出与盐酸反应的Fe,根据Fe2O3求出与Fe3+反应的Fe,在加上W的质量为Fe的质量,再加上Fe2O3中Fe的质量,则为Fe元素的总质量,再求出铁元素的质量分数.
解答:
解:(1)X为固体,Y为液体,分离固液混合物的操作为过滤,故答案为:过滤;
(2)某铁矿废料是由Fe、Fe2O3、Al2O3、SiO2中的几种物质组成,加氢氧化钠溶液过滤得到固体X,则X中含有Fe、Fe2O3,二者与盐酸反应,Fe与HCl反应的离子方程式为:Fe+2H+=Fe2++H2↑,Fe2O3与HCl反应生成Fe3+,Fe3+与Fe反应生成Fe2+,其离子方程式为2Fe3++Fe=3Fe2+,
故答案为:Fe+2H+=Fe2++H2↑;2Fe3++Fe=3Fe2+;
(3)a.X固体中含有Fe、Fe2O3,加盐酸反应后剩余的固体W为Fe,则W能与稀盐酸反应,故a正确;
b.Al2O3、SiO2均能与氢氧化钠溶液反应,所以由题中信息不能确定被氢氧化钠溶液溶解的物质,即不能确定铁矿废料中是否含有Al2O3,故b错误;
c.溶液Z为氯化亚铁,滴加几滴氯水会生成氯化铁,溶液变黄色,故c正确;
故答案为:ac;
(4)设Fe2O3为xmol,Fe为ymol,n(H2)=
=0.008mol,
Fe2O3+6H+=2Fe3++3H2O,
x 2x
Fe+2H+=Fe2++H2↑,
0.008mol 0.008mol
2Fe3++Fe=3Fe2+,
2x x
则160x+56y=2.72g,0.008mol+x+
=y,
解得:x=0.01、y=0.02,
则铁矿废料中铁元素总物质的量为n(Fe)=0.01×2+0.02=0.04mol,m(Fe)=0.04mol×56g/mol=2.24g,
所以铁元素的质量分数为
×100%=11.2%;
故答案为:11.2%.
(2)某铁矿废料是由Fe、Fe2O3、Al2O3、SiO2中的几种物质组成,加氢氧化钠溶液过滤得到固体X,则X中含有Fe、Fe2O3,二者与盐酸反应,Fe与HCl反应的离子方程式为:Fe+2H+=Fe2++H2↑,Fe2O3与HCl反应生成Fe3+,Fe3+与Fe反应生成Fe2+,其离子方程式为2Fe3++Fe=3Fe2+,
故答案为:Fe+2H+=Fe2++H2↑;2Fe3++Fe=3Fe2+;
(3)a.X固体中含有Fe、Fe2O3,加盐酸反应后剩余的固体W为Fe,则W能与稀盐酸反应,故a正确;
b.Al2O3、SiO2均能与氢氧化钠溶液反应,所以由题中信息不能确定被氢氧化钠溶液溶解的物质,即不能确定铁矿废料中是否含有Al2O3,故b错误;
c.溶液Z为氯化亚铁,滴加几滴氯水会生成氯化铁,溶液变黄色,故c正确;
故答案为:ac;
(4)设Fe2O3为xmol,Fe为ymol,n(H2)=
| V |
| Vm |
Fe2O3+6H+=2Fe3++3H2O,
x 2x
Fe+2H+=Fe2++H2↑,
0.008mol 0.008mol
2Fe3++Fe=3Fe2+,
2x x
则160x+56y=2.72g,0.008mol+x+
| 0.112 |
| 56 |
解得:x=0.01、y=0.02,
则铁矿废料中铁元素总物质的量为n(Fe)=0.01×2+0.02=0.04mol,m(Fe)=0.04mol×56g/mol=2.24g,
所以铁元素的质量分数为
| 2.24 |
| 20 |
故答案为:11.2%.
点评:本题考查了物质的分离操作、离子方程式的书写、物质含量的计算等,题目侧重于考查学生分析解决问题的能力和计算能力,题目难度中等.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
氧化还原反应在生产生活中具有广泛的用途.下列事实不涉及氧化还原反应的是( )
| A、食物腐败 |
| B、点制豆腐 |
| C、金属锈蚀 |
| D、久置氢氧化钠会变质 |
化学与材料、生活和环境密切相关.下列有关说法中错误的是( )
| A、处理废弃塑料制品较为合理的方法是使用化学方法把它加工成防水涂料或汽油等物质 |
| B、研制开发燃料电池汽车,降低机动车尾气排放,可以减少PM2.5污染 |
| C、新型材料聚酯纤维、光导纤维都属于有机高分子 |
| D、工厂利用胶体电泳性质采用静电除尘工艺,可部分降低细颗粒物造成的污染 |
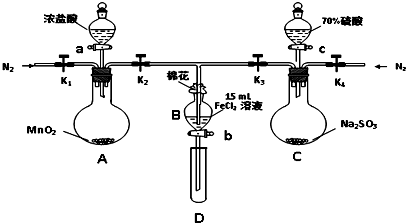
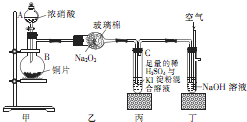 某学校化学学习小组为探究二氧化氮的性质,按图所示装置进行实验.请回答下列问题
某学校化学学习小组为探究二氧化氮的性质,按图所示装置进行实验.请回答下列问题