题目内容
下列说法正确的是( )
| A、将盐酸和醋酸钠溶液混合后溶液呈中性,溶液中c(Na+)=c(Cl-) |
| B、1 mol CH4分子中含有的共价键数目等于1 mol Na2O2固体中含有的离子总数 |
| C、80℃的纯水的pH大于25℃的纯水的pH |
| D、等体积、等物质的量浓度的NaCl溶液中离子总数大于NaClO溶液中离子总数 |
考点:弱电解质在水溶液中的电离平衡,水的电离,盐类水解的应用
专题:基本概念与基本理论
分析:A.溶液呈中性,则c(H+)=c(OH-),再结合电荷守恒判断;
B.1molCH4分子中含有4mol共价,1 mol Na2O2固体中含有的离子总数为3mol;
C.水的电离是吸热反应,升高温度促进水电离;
D.等体积、等物质的量浓度的NaCl、NaClO溶液中,NaCl和NaClO的物质的量相等,根据电荷守恒判断.
B.1molCH4分子中含有4mol共价,1 mol Na2O2固体中含有的离子总数为3mol;
C.水的电离是吸热反应,升高温度促进水电离;
D.等体积、等物质的量浓度的NaCl、NaClO溶液中,NaCl和NaClO的物质的量相等,根据电荷守恒判断.
解答:
解:A.A.溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(CH3COO-),所以c(Na+)>c(Cl-),故A错误;
B.1molCH4分子中含有4mol共价,1 mol Na2O2固体中含有的离子总数为3mol,故B错误;
C.水的电离是吸热反应,升高温度促进水电离,所以温度越高,水的电离程度越大,则水的pH越小,所以80℃的纯水的pH小于25℃的纯水的pH,故C错误;
D.等体积、等物质的量浓度的NaCl、NaClO溶液中,NaCl和NaClO的物质的量相等,溶液中存在c(Na+)+c(H+)=c(OH-)+c(Cl-)、c(Na+)+c(H+)=c(OH-)+c(ClO-),次氯酸钠溶液呈碱性,氯化钠呈中性,氯化钠中c(H+)大于次氯酸钠,NaCl、NaClO溶液中阴阳离子总数是阳离子的2倍,两种溶液中钠离子浓度相等,所以等体积、等物质的量浓度的NaCl溶液中离子总数大于NaClO溶液中离子总数,故D正确;
故选D.
B.1molCH4分子中含有4mol共价,1 mol Na2O2固体中含有的离子总数为3mol,故B错误;
C.水的电离是吸热反应,升高温度促进水电离,所以温度越高,水的电离程度越大,则水的pH越小,所以80℃的纯水的pH小于25℃的纯水的pH,故C错误;
D.等体积、等物质的量浓度的NaCl、NaClO溶液中,NaCl和NaClO的物质的量相等,溶液中存在c(Na+)+c(H+)=c(OH-)+c(Cl-)、c(Na+)+c(H+)=c(OH-)+c(ClO-),次氯酸钠溶液呈碱性,氯化钠呈中性,氯化钠中c(H+)大于次氯酸钠,NaCl、NaClO溶液中阴阳离子总数是阳离子的2倍,两种溶液中钠离子浓度相等,所以等体积、等物质的量浓度的NaCl溶液中离子总数大于NaClO溶液中离子总数,故D正确;
故选D.
点评:本题考查了弱电解质的电离,根据弱电解质的电离影响因素、物质的结构、盐类水解等知识点来分析解答,易错选项是D,根据电荷守恒再结合溶液中存在的阳离子浓度判断离子总数大小,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在铝质易拉罐中收集满CO2气体,然后倒入10mL浓NaOH溶液,迅速密封易拉罐口,可观察到易拉罐突然变瘪了,一段时间后,又可观察到的现象是 .出现上述现象的原因是 ,写出有关的两个化学方程式: 、 .
下列有关化学用语以及化学基本概念的表述中正确的一组是( )
A、过氧乙酸( )与羟基乙酸( )与羟基乙酸( )所含官能团相同,两者互为同分异构体 )所含官能团相同,两者互为同分异构体 |
| B、日本福岛核电站泄露的放射性核素 53 131I和 55 137Cs,前者比后者少4个中子 |
| C、淀粉和纤维素不是同分异构体,但属于同系物 |
| D、糖类、油脂、蛋白质都是由C、H、O三种元素组成的 |
下列各组离子在溶液中能大量共存的是( )
| A、CH3COO-、Cl-、K+、H+ |
| B、SO42-、Cl-、Ba2+、Na+ |
| C、Cl-、NO3-、NH4+、Na+ |
| D、HCO3-、NO3-、Al3+、K+ |
将8g铁片放入100mL CuSO4溶液中,Cu2+全部被置换后,取出附有铜的铁片洗涤、干燥、称重,其质量变为8.2g,则原溶液中CuSO4的物质的量浓度是( )
| A、0.125 mol/L |
| B、0.175 mol/L |
| C、0.25 mol/L |
| D、0.5 mol/L |
某一元弱酸HX的相对分子质量为M,t℃时,将ag HX溶解于一定量的水中恰好形成饱和溶液V mL,其密度为dg/cm3,其中n(X-)=b mol.关于该溶液的说法错误的是( )
A、溶液中c(H+)-c(OH-)=
| ||
B、物质的量浓度c(HX)=1000
| ||
C、t℃时,溶液中由水电离产生的c(H+)=
| ||
D、该温度下饱和溶液中HX的质量分数w%=
|
关于如图装置的叙述,不正确的是( )
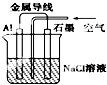

| A、铝是负极,铝片上析出无色气体 |
| B、石墨是正极,石墨棒上析出黄绿色气体 |
| C、溶液中两电极间产生白色沉淀 |
| D、溶液中Na+向石墨方向移动 |
下列说法不正确的( )
| A、物质燃烧总是放热的 |
| B、大多数化合反应都是放热的,大多数分解反应都是吸热的 |
| C、有些放热反应在引发反应时必须加热 |
| D、放热反应在反应发生时都不需要加热 |
