题目内容
13.已知下列热化学方程式:①H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol
③C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ/mol
④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是①②③④.
(2)燃烧10g H2生成液态水,放出的热量为1429.0kJ
(3)表示CO燃烧热的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ/mol.
分析 (1)①②③④上述反应中的△H<0,所以都是放热反应;
(2)由①热化学方程式可知,消耗2g的氢气放出的热量为:285.8kJ;
(3)根据盖斯定律,③C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ/mol;④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol;CO燃烧热的热化学方程式中的燃烧热为:④-③.
解答 解:(1))①②③④上述反应中的△H<0,所以都是放热反应,故答案为:①②③④;
(2)由①热化学方程式可知,消耗2g的氢气放出的热量为:285.8kJ,所以燃烧10g H2生成液态水,放出的热量为1429.0 kJ,故答案为:1429.0 kJ;
(3)根据盖斯定律,③C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ/mol;④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol;CO燃烧热的热化学方程式中的燃烧热为:④-③,所以CO燃烧热的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0 kJ/mol,故答案为:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0 kJ/mol.
点评 本题考查了根据热化学方程式的计算以及盖斯定律的应用,有关盖斯定律的习题,首先要根据所求的反应分析,分析以下几点:
1、所求反应中的反应物在哪个反应了?是反应物还是生成物?
2、所给反应中哪些物质是所求反应中没有的?
3、如何才能去掉无用的?然后,通过相互加减,去掉无关物质.将所对应的△H代入上述化学方程式的加减中就可以了.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
3.某校研究性学习小组学习完卤族元素后,进行了如下实验探究.
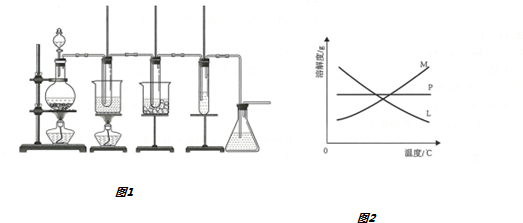
Ⅰ.在实验室用图1装置制取氯酸钾、次氯酸钠并探究氯水的性质
图1中:①为氯气发生装置;
②中试管里盛有15mL30%KOH溶液,并置于水浴中;
③中试管里盛有15mL8%NaOH溶液,并置于冰水浴中;
④中试管里加有紫色石蕊试液;
⑤为尾气吸收装置.
回答下列问题
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗(填写仪器名称)向烧瓶中加入适量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(填写编号字母)的净化装置.
A.碱石灰 B.饱和食盐水
C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是碱溶液(或反应物)的浓度不同,反应温度不同反应完毕经冷却后,②的试管中有大量晶体析出,图2中符合该晶体溶解度变化规律的曲线是M(填写编号字母);从②的试管中分离出该晶体的方法是过滤(填写实验操作名称)
(3)本实验中制取次氯酸钠的离子方程式是Cl2+2OH-═ClO-+Cl-+H2O
(4)实验中可观察到④的试管里溶液颜色发生了如下变化,请填写表中空白:
Ⅱ.在实验室用图3装置探究氯气的性质
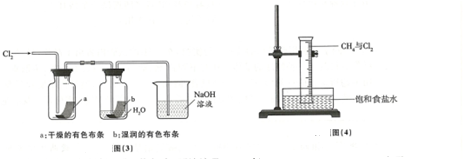
(5)将硫酸溶液滴入图3烧杯中,至溶液显酸性,结果也有Cl2生成,该反应的离子方程式是Cl-+ClO-+2H+=Cl2+H2O;
(6)将图4装置放置在光亮的地方(日光不直接照射),一段时间后,观察到量筒内壁上有油状液滴生成,量筒内液面上升.油状液地的成分可能是CH2Cl2、CHCl3、CCl4 (写分子式);量筒内液面上升的原因是氯化氢极易溶于水,量筒中压强减小,液面上升.

Ⅰ.在实验室用图1装置制取氯酸钾、次氯酸钠并探究氯水的性质
图1中:①为氯气发生装置;
②中试管里盛有15mL30%KOH溶液,并置于水浴中;
③中试管里盛有15mL8%NaOH溶液,并置于冰水浴中;
④中试管里加有紫色石蕊试液;
⑤为尾气吸收装置.
回答下列问题
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗(填写仪器名称)向烧瓶中加入适量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(填写编号字母)的净化装置.
A.碱石灰 B.饱和食盐水
C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是碱溶液(或反应物)的浓度不同,反应温度不同反应完毕经冷却后,②的试管中有大量晶体析出,图2中符合该晶体溶解度变化规律的曲线是M(填写编号字母);从②的试管中分离出该晶体的方法是过滤(填写实验操作名称)
(3)本实验中制取次氯酸钠的离子方程式是Cl2+2OH-═ClO-+Cl-+H2O
(4)实验中可观察到④的试管里溶液颜色发生了如下变化,请填写表中空白:
| 实验现象 | 原因 |
| 溶液从初的紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊试液变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为黄绿色 | 继续通入的氯气溶于水使溶液呈黄绿色 |

(5)将硫酸溶液滴入图3烧杯中,至溶液显酸性,结果也有Cl2生成,该反应的离子方程式是Cl-+ClO-+2H+=Cl2+H2O;
(6)将图4装置放置在光亮的地方(日光不直接照射),一段时间后,观察到量筒内壁上有油状液滴生成,量筒内液面上升.油状液地的成分可能是CH2Cl2、CHCl3、CCl4 (写分子式);量筒内液面上升的原因是氯化氢极易溶于水,量筒中压强减小,液面上升.
4.下列电离方程式不正确的是( )
| A. | Ca(OH)═Ca2++2OH- | B. | KNO3═K++NO3- | C. | NH4Cl═4NH++Cl- | D. | H2SO4═2H++SO42- |
1.下列各组离子,能在溶液中大量共存的是( )
| A. | Fe2+.Na+.NO3-.H+ | B. | NH4+.Fe3+.SO42-.SCN- | ||
| C. | SO42-.Cl-.Cu2+.Mg2+ | D. | Ba2+.K+.SO32-.H+ |
5.对于有机物氯乙烷的认识,下列说法中错误的是( )
| A. | 用乙烷和氯气混合光照充分反应,可以制得比较纯净的氯乙烷 | |
| B. | 可以用质谱仪快速、微量、精确地测定它的相对分子质量 | |
| C. | 与其它卤代烃一样,不溶于水,能溶于有机溶剂 | |
| D. | 它在氢氧化钠水溶液中,可以水解发生取代反应,生成乙醇 |
 A、B是两种有刺激性气味的气体,其水溶液都有漂白性,且当两者等物质的量通入到有色物质的溶液中时失去漂白性.试根据下列实验事实填空
A、B是两种有刺激性气味的气体,其水溶液都有漂白性,且当两者等物质的量通入到有色物质的溶液中时失去漂白性.试根据下列实验事实填空 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线: