题目内容
 物质结构决定物质的性质,物质性质反映了物质结构.
物质结构决定物质的性质,物质性质反映了物质结构.(1)BCl3、NCl3与水反应化学方程式如下:
BCl3+3H2O═B(OH)3+3HCl
NCl3+3H2O═NH3+3HOCl
分析上述反应,判断B、N、Cl三种元素的电负性由大到小的顺序是
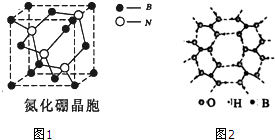
(2)BN是一种新型无机非金属材料,熔点很高、硬度很大,
晶胞结构如图1.BN晶体中存在的作用力有
A.σ键 B.π键 C.配位键 D.分子间作用力
(3)B(OH)3的晶体结构如图2所示.晶体中B原子的轨道杂化方式是
A.能溶于水 B.熔点很高 C.能形成[B(OH)4]D.硬度很大 E.熔化状态下能导电
(4)还原铁粉可作为合成氨的触媒.基态Fe原子的核外有
考点:元素电离能、电负性的含义及应用,原子核外电子排布,原子轨道杂化方式及杂化类型判断,不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:(1)原子获得电子的能力越强,元素的电负性就越大,在化合物中显示负价;在NH3和NCl3中N原子为SP3杂化;
(2)BN晶体属于原子晶体;
(3)B(OH)3中B原子电子对数=3+
=3,故为sp2杂化;B(OH)3属于分子晶体,结合相似相溶原理,可以判断其性质;
(4)基态Fe原子核外电子排布为1s22s22p63s23p63d64s2;二价铁失去一个电子后d轨道形成5个电子的半充满稳定结构.
(2)BN晶体属于原子晶体;
(3)B(OH)3中B原子电子对数=3+
| 3-1×3 |
| 2 |
(4)基态Fe原子核外电子排布为1s22s22p63s23p63d64s2;二价铁失去一个电子后d轨道形成5个电子的半充满稳定结构.
解答:
解:(1)元素的原子半径越小,原子获得电子的能力越强,元素的电负性就越大,根据元素在化学反应中生成物的化合价的正负可知B、N、Cl三种元素的电负性由大到小的顺序是N>Cl>B;在NH3和NCl3中N原子电子对数=3+
=4,故为SP3杂化,所以分子构型均为三角锥形;
故答案为:N>Cl>B;NH3、NCl3;
(2)BN是一种新型无机非金属材料,熔点很高、硬度很大,所以该晶体属于原子晶体,在晶体中存在σ键和配位键,所以选AC;
故答案为:AC;
(3)在B(OH)3中B原子电子对数=3+
=3,故为SP2杂化;B(OH)3属于分子晶体,结合相似相溶原理,B(OH)3可能具有的性质是能溶于水,熔点不高,能形成类似NaB(OH)4的物质,硬度小,在熔融状态下不能导电;
故答案为:sp2;AC;
(4)Fe是26号元素,基态Fe原子核外电子排布为1s22s22p63s23p63d64s2,有4个3d轨道上的电子未成对;二价铁易被氧化为三价铁的原因是二价铁失去一个电子后d轨道形成5个电子的半充满稳定结构.
故答案为:4;二价铁失去一个电子后d轨道形成半充满结构.
| 5-1×3 |
| 2 |
故答案为:N>Cl>B;NH3、NCl3;
(2)BN是一种新型无机非金属材料,熔点很高、硬度很大,所以该晶体属于原子晶体,在晶体中存在σ键和配位键,所以选AC;
故答案为:AC;
(3)在B(OH)3中B原子电子对数=3+
| 3-1×3 |
| 2 |
故答案为:sp2;AC;
(4)Fe是26号元素,基态Fe原子核外电子排布为1s22s22p63s23p63d64s2,有4个3d轨道上的电子未成对;二价铁易被氧化为三价铁的原因是二价铁失去一个电子后d轨道形成5个电子的半充满稳定结构.
故答案为:4;二价铁失去一个电子后d轨道形成半充满结构.
点评:本题考查了元素的电负性的比较、物质的分子结构、原子的杂化、原子的稳定状态等知识,难度较大,认真审题.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
对于常温下pH为1的硝酸溶液,下列叙述正确的是( )
| A、硝酸为弱电解质 |
| B、该溶液1 mL稀释至100 mL后,pH小于3 |
| C、向该溶液中加入等体积、等浓度的氢氧化钡溶液,混合后溶液pH=7 |
| D、该溶液中水电离出的c(H+)=1×10-13 mol/L |
下列关于有机化合物的说法正确的是( )
| A、煤的干馏可得到焦碳、煤油等 |
| B、戊烷(C5H12)有两种同分异构体 |
| C、乙烯和苯分子均含有碳碳双键 |
| D、苯与浓硝酸生成硝基苯的反应属于取代反应 |
下列有机化合物中不属于烃的是( )
| A、乙烷 | B、乙烯 | C、乙醇 | D、苯 |
下列物质性质变化规律正确的是( )
| A、金属Na、Mg、Al的硬度依次降低 |
| B、HI、HBr、HCl、HF的稳定性依次减弱 |
| C、干冰、钠、冰的熔点依次降低 |
| D、O、F、H的原子半径依次减小 |
能正确表示下列反应的离子方程式是( )
| A、硫酸铝溶液中加入过量氨水 Al3++3OH-═Al(OH)3↓ |
| B、碳酸钠溶液中加入澄清石灰水 CO32-+Ca(OH)2+═CaCO3↓+2OH- |
| C、氢氧化钠溶液中通入氯气 Cl2+2OH-═Cl-+ClO-+H2O |
| D、足量稀硝酸中加入铁粉 2Fe+6H+═2Fe3++3H2↑ |
下列方程式书写正确的是( )
| A、H2SO3的电离方程式H2SO3?2H++SO32- |
| B、HCO3-在水溶液中的电离方程式:HCO3-+H2O?H3O++CO32- |
| C、CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- |
| D、CaCO3的电离方程式:CaCO3?Ca2++CO32- |
