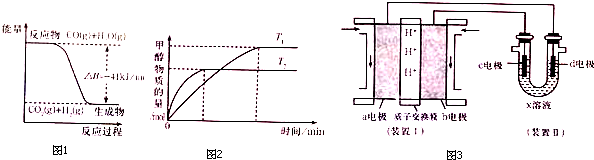
题目内容
3.下列反应属于吸热反应的是( )①二氧化碳与赤热的炭反应生成一氧化碳 ②葡萄糖在人体内氧化分解
③锌粒与稀H2SO4反应制取H2④Ba(OH)2•8H2O固体与NH4Cl固体反应
⑤植物通过光合作用将CO2转化为葡萄糖.
| A. | ②④ | B. | ①⑤ | C. | ①③④⑤ | D. | ①④⑤ |
分析 据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱);
解答 解:①二氧化碳与赤热的炭反应生成一氧化碳是吸热反应,故①正确;
②葡萄糖在人体内氧化分解的反应是放热反应,故②错误;
③锌粒与稀H2S04反应是常见放热反应,故③错误;
④Ba(OH)2•8H20与NH4Cl反应是吸热反应,故④正确;
⑤植物通过光合作用将CO2转化为葡萄糖是吸热反应,故⑤正确.
故选D.
点评 本题考查学生常见的放热反应和吸热反应,熟记常见的放热反应和吸热反应是解题的关键,注意归纳常见的吸热反应,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.Al(OH)3即能与酸起反应,又能与强碱溶液起反应生成盐和水,说明Al(OH)3属于( )
| A. | 两性氧化物 | B. | 两性氢氧化物 | C. | 盐 | D. | 有机物 |
18.还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
2CrO${\;}_{4}^{2-}$$\underset{\stackrel{{H}^{+}}{→}}{转换}$Cr2O${\;}_{7}^{2-}$$\underset{\stackrel{F{e}^{2+}}{→}}{还原}$Cr3+$\underset{\stackrel{O{H}^{-}}{→}}{沉淀}$Cr(OH)3↓
已知转化过程中的反应为2CrO${\;}_{4}^{2-}$(aq)+2H+(aq)?Cr2O${\;}_{7}^{2-}$(aq)+H2O(l)
,转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有$\frac{10}{11}$转化为Cr2072-,下列说法不正确的是( )
2CrO${\;}_{4}^{2-}$$\underset{\stackrel{{H}^{+}}{→}}{转换}$Cr2O${\;}_{7}^{2-}$$\underset{\stackrel{F{e}^{2+}}{→}}{还原}$Cr3+$\underset{\stackrel{O{H}^{-}}{→}}{沉淀}$Cr(OH)3↓
已知转化过程中的反应为2CrO${\;}_{4}^{2-}$(aq)+2H+(aq)?Cr2O${\;}_{7}^{2-}$(aq)+H2O(l)
,转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有$\frac{10}{11}$转化为Cr2072-,下列说法不正确的是( )
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeS04•7H2O)作还原剂,处理1 L废水,至少需要458.7g | |
| C. | 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5 | |
| D. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 |
8.国际无机化学命名委员会在1989年做出决定,把元素周期表原先的主、副族及族号取消,由左至右改为18列.如碱金属元素为第1列,稀有气体元素为第18列.按此规定,下列说法错误的是( )
| A. | 只有第2列元素的原子最外层有2个电子 | |
| B. | 第3列元素种类最多 | |
| C. | 第15列元素的最高价氧化物为R2O5 | |
| D. | 第17列元素的第一种元素无含氧酸 |
13.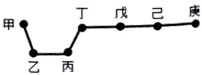 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )| A. | 甲一定是金属元素 | |
| B. | 气态氢化物的稳定性:庚>己>戊 | |
| C. | 乙、丙、丁的最高价氧化物水化物可以以相互反应 | |
| D. | 庚的最高价氧化物水化物酸性最强 |
 )广泛用于集成电路的制备和微细图形的加工.下面是有机物X的一种合成路线:
)广泛用于集成电路的制备和微细图形的加工.下面是有机物X的一种合成路线: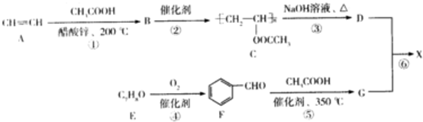

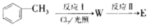
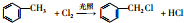 ,反应Ⅱ的试剂为氢氧化钠水溶液、加热.
,反应Ⅱ的试剂为氢氧化钠水溶液、加热.
 ,E的化学式为NO.
,E的化学式为NO. .
. .
.