题目内容
12.“CCS技术”是将工业和有关能源产业中所产生的CO2进行捕捉与封存的技术,被认为是应对全球气候变化最重要的手段之一.一种以天然气为燃料的“燃烧前捕获系统”的简单流程如图所示(部分物质及条件未标出):
(1)CH4在催化剂作用下实现第一步转化,也叫CH4的不完全燃烧,1gCH4不完全燃烧反应放出2.21kJ热量,该反应的热化学方程式为2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-70.72kJ•mol-1.
(2)第二步的反应为:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图1所示,反应物分子化学键断裂时所吸收的总能量小于(填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量.相同温度下,若在2L密闭容器中CO(g)和H2O(g)的起始浓度均为0.5mol•L-1,上述反应达到平衡时放出的热量为32.8kJ,则平衡时CO的转化率为80%.
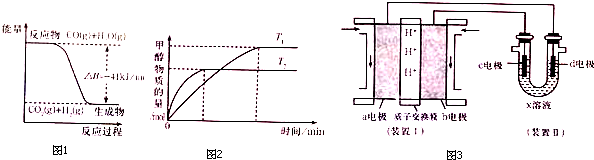
(3)工业上可用上述转化中得到的合成气制备甲醇,其反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).现将1mol CO2和3molH2充入容积为2L的密闭容器中发生上述反应,(见图2)下列说法正确的是BD.
A.若保持温度不变,当容器中的n(CH3OH):n(H2O)为1:1时,该反应已达到平衡状态
B.若保持温度不变,当容器内气体压强恒定时,该反应已达到平衡状态
C.若其他条件不变,实验结果如图所示(T1、T2均大于300℃),平衡常数、:K(T1)<K(T2)
D.若保持温度不变,当反应已达平衡时,再向容器中充入1molCO2和3molH2,当达到新平衡时,n(CH3OH):n(H2)的值将升高
(4)某同学按如图3所示的装置用甲醇燃料电池(装置Ⅰ)进行电解的相关操作,以测定铜的相对原子质量,其中c电极为铜棒,d电极为石墨,X溶液为500mL0.4mol•L-1硫酸铜溶液.当装置Ⅱ中某电极上收集到标准状况下的气体VmL时,另一电极增重mg(m<12.8)
①装置Ⅰ中H+向a(填“a”或“b”)极移动;b极上的电极反应式为CH3OH-6eˉ+H2O=CO2+6H+.
②铜的相对原子质量的表达式为$\frac{11200m}{{V}_{1}}$(用含m和V的代数式表示)
分析 (1)根据流程图可知甲烷不完全燃烧生成一氧化碳和氢气,依据热化学方程式的书写方法写出,标注物质聚集状态和对应焓变;
(2)图象分析可知反应是放热反应,CO(g)+H2O(g)?CO2(g)+H2(g),△H=-41KJ/mol,形成化学键放出能量高于反应物断裂化学键吸收能量,上述反应达到平衡时放出的热量为32.8kJ,计算消耗的CO物质的量,结合转化率=$\frac{消耗量}{起始量}$×100%计算;
(3)A、无论反应是否达到平衡状态,n(CH3OH):n(H2O)为1:1;
B、当反应前后改变的物理量不变时,该反应达到平衡状态;
C、根据“先拐先平数值大”判断;
D、保持温度不变,当反应已达平衡时,若向容器中再充入1mol CO2和3mol H2,相当于增大压强,平衡向气体体积减小的方向移动.
(4)①由装置II中某电极上收集到标准状况下的气体V1mL时,另一电极增重mg可知,d极为阳极,而c极为阴极;
②根据阳极产生气体的体积,求出整个过程中转移电子的物质的量,然后铜的相对原子质量.
解答 解:(1)根据流程图可知甲烷不完全燃烧生成一氧化碳和氢气,1gCH4燃烧生成一氧化碳和氢气放热2.21kJ,16g甲烷燃烧生成二氧化碳和液态水放出热量16×2.21kJ=35.36KJ,16g甲烷为1mol,则甲烷不完全燃烧的热化学方程式为:2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-70.72 kJ•mol-1,
故答案为:2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-70.72 kJ•mol-1;
(2)图象分析可知反应是放热反应,CO(g)+H2O(g)?CO2(g)+H2(g),△H=-41KJ/mol,形成化学键放出能量高于反应物断裂化学键吸收能量,上述反应达到平衡时放出的热量为32.8kJ,计算消耗的CO物质的量=$\frac{32.8KJ}{41KJ}$×1mol=0.8mol,一氧化碳转化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.8mol}{2L×0.5mol/L}$×100%=80%;
故答案为:小于;80%;
(3)A、若保持恒温,无论该反应是否达到平衡状态,容器中n(CH3OH):n(H2O)始终为1:1,所以不能据此判断平衡状态,故错误;
B、该反应是反应气体体积减小的反应,若保持恒温,当容器内气体压强恒定时,该反应已达平衡状态,故正确;
C、根据“先拐先平数值大”知T1<T2,升高温度,甲醇的物质的量减小,则平衡向逆反应发现移动,所以平衡常数:K(T1)>K (T2),故错误;
D、保持温度不变,当反应已达平衡时,若向容器中再充入1mol CO2和3mol H2,相当于增大压强,平衡向正反应方向移动,且反应物的转化为大于原来平衡转化率,所以当达到新平衡时,n(CH3OH):n(H2)将升高,故正确;
故选BD;
(4)①由装置II中某电极上收集到标准状况下的气体V1mL时,另一电极增重mg可知,d极为阳极,而c极为阴极,所以与d极相连的a极为正极,原电池中阳离子向正极移动,b电极为负极是燃料发生氧化反应,反应方程式为:CH3OH-6eˉ+H2O=CO2+6H+,
故答案为:a;CH3OH-6eˉ+H2O=CO2+6H+;
②整个过程中转移电子的物质的量为:$\frac{1{0}^{-3}×{V}_{1}}{22.4}$,所以生成铜的物质的量为:$\frac{{V}_{1}}{11200}$,所以铜的相对原子质量的表达式为$\frac{11200m}{{V}_{1}}$,故答案为:$\frac{11200m}{{V}_{1}}$.
点评 本题主要考查了化学平衡以及平衡图象分析,化学反应热、平衡的移动和电化学的相关知识,根据化学平衡的判断方法等知识点来分析解答,题目综合性强,难度中等.

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案| A. | 醛基的电子式: | B. | 丙烷分子的比例模型: | ||
| C. | 三硝基甲苯的结构  | D. | 2-乙基-1,3-丁二烯分子的键线式: |
①二氧化碳与赤热的炭反应生成一氧化碳 ②葡萄糖在人体内氧化分解
③锌粒与稀H2SO4反应制取H2④Ba(OH)2•8H2O固体与NH4Cl固体反应
⑤植物通过光合作用将CO2转化为葡萄糖.
| A. | ②④ | B. | ①⑤ | C. | ①③④⑤ | D. | ①④⑤ |
| 弱酸 | H2CO3 | H2SO3 | HClO |
| 电离平衡常数 (25℃) | K1=4.30×10-7 | K1=1.54×10-2 | K=2.95×10-8 |
| K2=5.61×10-11 | K2=1.02×10-7 |
| A. | 相同温度时三种溶液的pH关系:Na2CO3>NaClO>Na2SO3 | |
| B. | ClO-+H2O+CO2→HClO+HCO3- | |
| C. | 2ClO-+SO2+H2O→2HClO+SO32- | |
| D. | 等体积、等物质的量浓度的HClO和Na2CO3混合后溶液呈中性 |
| A. | Ca2++ClO-+SO2+H2O→CaSO4↓+Cl-+2H+ | |
| B. | Ca2++2ClO-+2SO2+2H2O→CaSO4↓+2Cl-+2H++SO42- | |
| C. | Ca2++3ClO-+3SO2+3H2O→CaSO4↓+3Cl-+6H++2SO42- | |
| D. | Ca2++3ClO-+SO2+H2O→CaSO4↓+2HClO+Cl- |
| A. | 镁、NaOH溶液 | B. | 铜、稀硫酸 | C. | 锌、浓硝酸 | D. | 铁、FeCl3 |
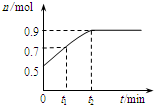 一定温度下:在2.0L密闭容器中,发生X(g)?Y(g)+Z(g)△H<0,容器内反应物X的物质的量随反应时间t的变化关系如图所示.以下分析正确的是( )
一定温度下:在2.0L密闭容器中,发生X(g)?Y(g)+Z(g)△H<0,容器内反应物X的物质的量随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | 从反应开始到t1时的平均反应速率为v(X)=$\frac{0.2}{{t}_{1}}$ mol/(L•min) | |
| B. | 反应达到平衡时,Y和Z的物质的量共减少0.8mol | |
| C. | 欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 | |
| D. | 反应到t2时刻后,保持其他条件不变,缩小容器的体积,再次平衡后,X的物质的量小于0.9mol |
已知:反应Ⅰ:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应I和反应II在不同温度时的平衡常数及其大小关系如表
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.

①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1•min-1.
②下列说法正确的是CD.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,分析NO2体积分数--φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2)不变;恒温恒容容器,φ(NO2)变大.
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3L,c(N2)与反应时间t变化曲线X如图所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z.则:
①变为曲线Y改变的条件是加入催化剂.变为曲线Z改变的条件是将容器的体积快速压缩至2L.
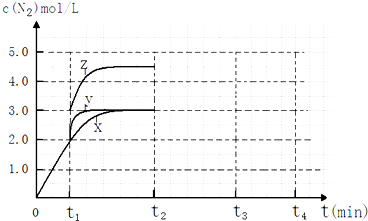
②若t2降低温度,t3达到平衡,请在图中画出曲线X在t2-t4内 c(N2)的变化曲线.
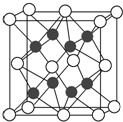 化合物Na2O的晶胞如图.
化合物Na2O的晶胞如图.