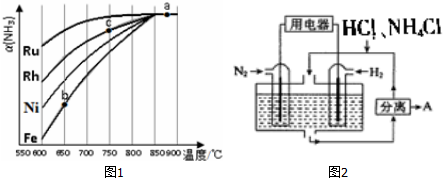
题目内容
17. 乙醇可用来制取乙醛、乙醚、乙酸乙酯等化工原料,也是制取染料、涂料、洗涤剂等产品的原料.
乙醇可用来制取乙醛、乙醚、乙酸乙酯等化工原料,也是制取染料、涂料、洗涤剂等产品的原料.(1)已知常温常压下:
①CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H1=-1366.8kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566kJ•mol-1
③H2O(g)═H2O(l)△H3=-44kJ•mol-1
则CH3CH2OH(l)和O2生成CO和H2O(l)的热化学方程式为CH3CH2OH(l)+2O2(g)=2CO(g)+3H2O(l)△H=-932.8 kJ•mol-1.
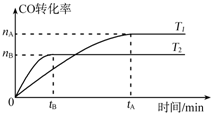
(2)在容积为2L的密闭容器中,由CO和H2合成由乙醇的反应为2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g),在其他条件不变的情况下,CO的转化率随温度的变化如图所示(注:T1、T2均大于280℃):
①根据如图可推知T2>T1(填“>”、“<”或“=”).
②该反应△H<0(填“>”、“<”或“=”);升高温度,上述反应向逆(填“正”或“逆”)反应方向移动.
③该反应的平衡常数表达式为K=$\frac{c(C{H}_{3}C{H}_{2}OH)•c({H}_{2}O)}{{c}^{2}(CO)•{c}^{4}({H}_{2})}$,降低温度平衡常数将变大(填“变大”、“变小”或“不变”,下同),反应速率将变小.
分析 (1)根据盖斯定律方程式①-②+③×3得到CH3CH2OH(l)+2O2(g)=2CO(g)+3H2O(l)据此计算;
(2)①温度越高,反应速率越大,反应达到平衡时所用时间越短;
②升高温度平衡向吸热方向移动,结合反应热判断;
③平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,降低温度,反应速率减小,根据平衡移动判断平衡常数的变化.
解答 解:(1)已知常温常压下:
①CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H1=-1366.8kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566kJ•mol-1
③H2O(g)═H2O(l)△H3=-44kJ•mol-1
由盖斯定律方程式①-②+③×3得到CH3CH2OH(l)+2O2(g)=2CO(g)+3H2O(l)△H=(-1366.8)-(-566)+(-44)×3kJ•mol-1=-932.8 kJ•mol-1,
故答案为:CH3CH2OH(l)+2O2(g)=2CO(g)+3H2O(l)△H=-932.8 kJ•mol-1;
(2)①温度越高,反应速率越大,反应达到平衡时所用时间越短,由图象可知,T2温度时反应先达到平衡状态,即T2时速率快,温度高,所以T2大于T1;
故答案为:>;
②由图可知,升高温度,CO的转化率减小,即升高温度平衡向逆方向移动,则正反应为放热反应,即△H<0;
故答案为:<;逆;
③2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)的平衡常数的表达式为K=$\frac{c(C{H}_{3}C{H}_{2}OH)•c({H}_{2}O)}{{c}^{2}(CO)•{c}^{4}({H}_{2})}$,降低温度,反应速率减小,该反应为放热反应,降低温度平衡向正方向移动,化学平衡常数增大;
故答案为:K=$\frac{c(C{H}_{3}C{H}_{2}OH)•c({H}_{2}O)}{{c}^{2}(CO)•{c}^{4}({H}_{2})}$;变大;变小.
点评 本题考查了盖斯定律的应用和热化学方程式的书写、影响反应速率和化学平衡的因素、化学平衡常数等,题目难度中等,注意把握盖斯定律的含义和应用方法、以及温度对反应速率和化学平衡的影响.

| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
(1)写出该反应的化学平衡常数表达式:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,a小于(填“大于”、“小于”或“等于”)0.
(2)200℃时,向此密闭容器中充入0.20mol的N2和0.80mol的H2,反应初始6s内达到了平衡状态,N2的平均反应速率v(N2)=0.03mol•L-1•s-1.则6s时NH3的物质的量为0.18mol,c(N2)=0.22mol•L-1;此时N2的转化率为45%,如果这时向该密闭容器中再充入1mol氩气,N2的转化率不变(填“增大”“不变”“减小”).
(3)400℃时,2NH3(g)?N2(g)+3H2(g)的化学平衡常数为2,测得氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,该反应的v正(N2)大于(填“大于”、“小于”或“等于”)v逆(N2).
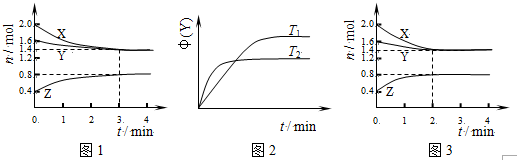
| A. | 容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | |
| B. | 反应进行的前3min内,用X表示的反应速率v(X)=0.2mol•(L•min)-1 | |
| C. | 保持其他条件不变,升高温度,反应的化学平衡常数K减小 | |
| D. | 其它条件不变,使用催化剂,则反应进程可能如图3所示 |
(一) 有无色溶液,可能含有K+、SO42-、CO32-、NH4+、Cl-、Ba2+、Cu2+中的一种或几种,按以下步骤进行实验:
①取100ml溶液往其中加入足量稀硫酸,有0.224L(标况下)气体产生;
②另取100ml溶液滴加足量Ba(NO3)2溶液,有4.2g白色沉淀生成
③继续向②中的溶液滴加足量NaOH溶液并加热,产生刺激性气味的气体0.672L(标况下);
根据以上事实判断:
(1)肯定存在的是CO32-、SO42-、NH4+、K+;
(2)肯定不存在的是Cu2+,Ba2+;
(3)不能确定是否存在的是Cl-.请简述证明该物质是否存在的实验方案(实验方法、现象、结论)将②所得混合物过滤,向滤液中加入硝酸酸化的硝酸银,若产生白色沉淀,证明原溶液中含有氯离子,否则不含氯离子
(二).某学习小组设计以下四个实验探究氯水的成分,请根据表回答问题.
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
| ② | 将氯水滴加到紫色石蕊试液中 | 氯水中不仅有H+还有HClO | |
| ③ | 将氯水滴加到淀粉-KI试纸上 | 淀粉-KI试纸变蓝 (I2遇淀粉变蓝) | 氯水中有Cl2 |
| ④ | 将足量的氯水滴加到NaHCO3溶液中 | 有气泡生成 |
①氯水中含有Cl-,④氯水中含有H+.
(2)指出实验②中的“实验现象”为紫色石蕊先变红后褪色.
(3)实验③中的离子反应方程式Cl2+2I-=2Cl-+I2.
| A. | 2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3•H2O | |
| B. | 2NO2+2OH-=NO3-+NO2-+H2O | |
| C. | SnCl4+2H2O=SnO2+4HCl | |
| D. | CO32-+CO2+H2O=2HCO3- |