题目内容
7.化学方程式可简明地体现元素及其化合物的性质.已知氧化还原反应:2FeCl2+Cl2=2FeCl3
2Co(OH)3+6HCl=2CoCl2+Cl2↑+6H2O
2FeCl3+2HI=2FeCl2+I2+2HCl;
复分解反应:2CH3COOH+K2CO3=2CH3COOK+CO2↑+H2O;
KCN+CO2+H2O=HCN+KHCO3
热分解反应:4KClO $\frac{\underline{\;\;△\;\;}}{\;}$3KCl+KClO4; KClO4 $\frac{\underline{\;\;△\;\;}}{\;}$KCl+2O2↑
根据以上反应分析下列说法正确是( )
| A. | 还原性(酸性溶液):HCl>CoCl2>HI | B. | 酸性(水溶液):CH3COOH>HCN>H2CO3 | ||
| C. | 热稳定性:KCl<KClO4<KClO | D. | 氧化性(酸性溶液):Co(OH)3>FeCl3>I2 |
分析 A、根据还原剂的还原性大于还原产物的还原性来判断;
B、根据化学反应遵循强酸制弱酸的规律来判断;
C、根据物质分解时生成更加稳定的物质来判断;
D、根据氧化剂的氧化性大于氧化产物的氧化性判断.
解答 解:A、在 2Co(OH)3+6HCl=2CoCl2+Cl2↑+6H2O反应中,还原性:HCl>CoCl2,但无法比较CoCl2与HI的还原性,故A错误;
B、化学反应遵循强酸制弱酸的规律,在反应2CH3COOH+K2CO3=2CH3COOK+CO2↑+H2O中,酸性CH3COOH>H2CO3,在反应中 KCN+CO2+H2O═HCN+KHCO3,酸性H2CO3>HCN,则酸性为CH3COOH>H2CO3>HCN,故B错误;
C、物质分解时生成更加稳定的物质,在反应中4KClO $\frac{\underline{\;\;△\;\;}}{\;}$3KCl+KClO4,稳定性KClO4>KClO,在反应中KClO4 $\frac{\underline{\;\;△\;\;}}{\;}$KCl+2O2↑
中,稳定性KCl>KClO4,则稳定性KCl>KClO4>KClO,故C错误;
D、在2FeCl3+2HI═2FeCl2+I2+2HCl反应中,氧化性:FeCl3>I2,在2Co(OH)3+6HCl═2CoCl2+Cl2↑+6H2O中,氧化性:Co(OH)3>Cl2,在2FeCl2+Cl2=2FeCl3反应中,氧化性:Cl2>FeCl3,故Co(OH)3>FeCl3,则有:Co(OH)3>FeCl3>I2,故D正确;
故选D.
点评 本题考查氧化性、还原性、稳定性和酸性的比较,做题时注意积累比较物质的性质的规律和方法.

练习册系列答案
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
2.下列说法不正确的是( )
| A. | 等温等压条件下,5 mol O2(g)和2 mol H2(g)的体积之比等于5:2 | |
| B. | 等温等压下,SO2气体与CO2气体的密度之比等于16:11 | |
| C. | 温度和容积相同的两气罐中分别盛有5 mol O2(g)和2 mol N2(g),压强之比等于5:2 | |
| D. | 温度相同、体积相同的O2(g)和N2(g)分子数相同 |
18.下列有关化学用语正确的是( )
| A. | NH4Cl的电子式: | B. | 中子数为18的氯原子:${\;}_{17}^{35}$Cl | ||
| C. | 碳酸的电离:H2CO3?2H++CO32- | D. | 次氯酸的结构式:H-Cl-O |
15.下列各组物质中,其分子数相同的是( )
| A. | 1 g H2和8 g O2 | |
| B. | 1 mol CO和22.4 L CO2 | |
| C. | 标准状况下,1.12 L N2和2.24 L He | |
| D. | 常温常压下,16 g O2和0.5 mol N2 |
12.有机物 的正确命名为( )
的正确命名为( )
 的正确命名为( )
的正确命名为( )| A. | 2 一乙基一 3,3 一二甲基戊烷 | B. | 3,3-二甲基-4-乙基戊烷 | ||
| C. | .3.3,4 一三甲基己烷 | D. | 3,4,4-三甲基烷己烷 |
17.某温度时,Ag2SO4在水中的沉淀溶解曲线如图所示.该温度下,下列说法正确的是( )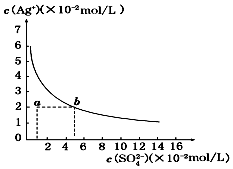

| A. | 含有大量SO42-的溶液中肯定不存在Ag+ | |
| B. | 0.02 mol/L的AgNO3溶液与0.2 mol/L的Na2SO4溶液等体积混合不会生成沉淀 | |
| C. | Ag2SO4的溶度积常数(Ksp)为1×10-3 | |
| D. | a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |