题目内容
某有机物A由C、H、O三种元素组成,11.5gA完全燃烧可生成22gCO2和13.5gH2O.试求:
(1)该有机物的最简式
(2)已知有机物A的质谱图和红外光谱图如下:

有机物A的结构简式为 .
(3)符合A的分子式的有机物可能不止一种,若其核磁共振氢谱图中只有一种峰,则其结构简式为 .
(4)有机物A与乙酸在一定条件下反应得到一种具有水果香味的液体,写出其反应的化学方程式 .
(1)该有机物的最简式
(2)已知有机物A的质谱图和红外光谱图如下:

有机物A的结构简式为
(3)符合A的分子式的有机物可能不止一种,若其核磁共振氢谱图中只有一种峰,则其结构简式为
(4)有机物A与乙酸在一定条件下反应得到一种具有水果香味的液体,写出其反应的化学方程式
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:(1)根据n=
计算出二氧化碳、水的物质的量,根据质量数可知该有机物中含有C、H的物质的量及质量,再计算出A中含有O元素的质量及物质的量,最后计算出其最简式;
(2)根据质谱图可知其相对分子质量为46,根据A的红外光谱可知A中含有C-H、C-O、O-H键,据此判断其结构;
(3)符合A的分子式的有机物可能不止一种,若其核磁共振氢谱图中只有一种峰,则A为甲醚;
(4)乙醇与乙酸发生酯化反应生成乙酸乙酯和水.
| m |
| M |
(2)根据质谱图可知其相对分子质量为46,根据A的红外光谱可知A中含有C-H、C-O、O-H键,据此判断其结构;
(3)符合A的分子式的有机物可能不止一种,若其核磁共振氢谱图中只有一种峰,则A为甲醚;
(4)乙醇与乙酸发生酯化反应生成乙酸乙酯和水.
解答:
解:(1)22g二氧化碳的物质的量为:
=0.5mol,A中含有C元素质量为:12g/mol×0.5mol=6g,
13.5g水的物质的量为:
=0.75mol,11.5gA中含有H原子的物质的量为:0.75mol×2=1.5mol,质量为1.5g,
所以11.5gA中含有O元素的质量为:11.5g-6g-1.5g=4g,氧原子的物质的量为:
=0.25mol,
则:n(C):n(H):n(O)=0.5mol:1.5mol:0.25mol=2:6:1,
所以化合物的最简式为C2H6O,
故答案为:CH2O;
(2)根据质谱图可知其相对分子质量为46,则A的分子式为C2H6O,根据A的红外光谱可知A中含有C-H、C-O、O-H键,所以A为乙醇,结构简式为:CH3CH2OH,
故答案为:CH3CH2OH;
(3)符合A的分子式的有机物可能不止一种,若其核磁共振氢谱图中只有一种峰,其分子中所有H原子位置等效,则A为二甲醚,其结构简式为:CH3OCH3,
故答案为:CH3OCH3;
(4)有机物A与乙酸在一定条件下反应得到一种具有水果香味的液体,该液体为乙酸乙酯,反应的化学方程式为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O.
| 22g |
| 44g/mol |
13.5g水的物质的量为:
| 13.5g |
| 18g/mol |
所以11.5gA中含有O元素的质量为:11.5g-6g-1.5g=4g,氧原子的物质的量为:
| 4g |
| 16g/mol |
则:n(C):n(H):n(O)=0.5mol:1.5mol:0.25mol=2:6:1,
所以化合物的最简式为C2H6O,
故答案为:CH2O;
(2)根据质谱图可知其相对分子质量为46,则A的分子式为C2H6O,根据A的红外光谱可知A中含有C-H、C-O、O-H键,所以A为乙醇,结构简式为:CH3CH2OH,
故答案为:CH3CH2OH;
(3)符合A的分子式的有机物可能不止一种,若其核磁共振氢谱图中只有一种峰,其分子中所有H原子位置等效,则A为二甲醚,其结构简式为:CH3OCH3,
故答案为:CH3OCH3;
(4)有机物A与乙酸在一定条件下反应得到一种具有水果香味的液体,该液体为乙酸乙酯,反应的化学方程式为:CH3COOH+CH3CH2OH
| 浓硫酸 |
| △ |
故答案为:CH3COOH+CH3CH2OH
| 浓硫酸 |
| △ |
点评:本题考查了有机物分子式、结构简式的确定,题目难度中等,试题涉及的知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用所学知识都能了,注意明确核磁共振氢谱、红外光谱、质谱图中曲线含义.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
下列关于第①步的说法,错误的是( )
| A、Al起始反应的离子方程式为2Al+6H+=2Al3++3H2↑ |
| B、滤液I中一定含有Cu2+、Al3+;一定含有Fe2+和Fe3+中的一种或两种 |
| C、滤渣I的主要成分是Au与Pt,由此可以回收贵重的金属 |
| D、加入稀硫酸可以提高硝酸的利用率,使硝酸根离子完全反应 |
下列的分离方法不正确的是( )
| A、用过滤的方法除去食盐水中的泥沙 |
| B、用蒸馏的方法将自来水制成蒸馏水 |
| C、用酒精萃取碘水中的碘 |
| D、用加热的方法除去苏打中的小苏打 |
设NA代表阿伏加德罗常数,下列叙述正确的是( )
| A、标准状况下,将5.6L的O2和5.6LNO的混合后的分子数约为0.5NA |
| B、2L 0.5mol/L BaCl2溶液中,阳离子所带电荷数为 NA |
| C、常温常压下,将0.2mol铝片投入含0.6molH2SO4的浓硫酸中,生成0.3 NA个SO2分子 |
| D、42g丙烯气体中,含有的σ键数目为8NA |
对实验Ⅰ~Ⅳ的叙述正确的是( )
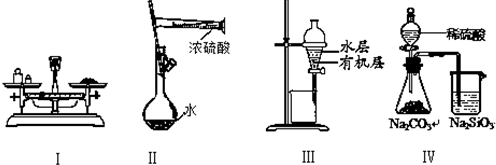

| A、实验Ⅰ:用托盘天平称量一定质量的氯化钠固体 |
| B、实验Ⅱ:配制一定物质的量浓度的硫酸 |
| C、实验Ⅲ:用苯萃取溴水中的溴后进行分液 |
| D、实验Ⅳ:比较硫酸、碳酸和硅酸酸性强弱 |
已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39KJ?mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46KJ?mol-1
H2(g)
O2(g)═H2O(l))△H=-285.84KJ?mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H20(l)的反应热△H等于( )
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46KJ?mol-1
H2(g)
| 1 |
| 2 |
在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H20(l)的反应热△H等于( )
| A、-319.68kJ?mol-1 |
| B、-417.91kJ?mol-1 |
| C、+546.69kJ?mol-1 |
| D、-448.46kJ?mol-1 |