题目内容
7. 甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.
甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.(1)一定条件下,用甲烷可以消除氮氧化物(NOx)的污染.已知:
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H1=-1160kJ/mo
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H2=-574kJ/mol
现有一份在相同条件下对H2的相对密度为17的NO与NO2的混合气体
①该混合气体中NO和NO2的物质的量之比为3:1
②在一定条件下NO气体可以分解为NO2气体和N2气体,写出该反应的热化学方程式
4NO(g)=2NO2(g)+N2(g)△H=-293kJ/mol
(2)以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:
③B极为电池负极,电极反应式为CH4-8e-+4O2-=CO2+2H2O.
④若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,写出阳极的电极反应式4OH--4e-=O2↑+2H2O,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为1.12L(标况下),实际上消耗的甲烷体积(折算到标况)比理论上大,可能原因为电池能量转化率达不到100%.
分析 (1)①相同条件下,不同气体的摩尔质量之比等于其密度之比,据此计算氮氧化物平均摩尔质量,再根据平均摩尔质量计算NO和二氧化氮的物质的量之比;
②根据盖斯定律及已知热化学方程式构造目标反应的热化学方程式;
(2)③B为负极,总反应式为CH4+2O2+=CO2+2H2O,正极反应式为:2O2+8e-=4O2-,两式相减可得负极电极反应式;
④开始阶段发生反应:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,铜离子完全放电后,发生反应2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,阳极的电极反应式是氢氧根离子放电,当两极收集到的气体体积相等时,即氢气与氧气的体积相等,令是氢气为xmol,根据电子转移守恒列方程计算,再根据电子转移守恒计算消耗的甲烷;根据电池中的能量转化率分析.
解答 解:(1)①在相同条件下对H2的相对密度为17的NO与NO2的混合气体,相同条件下,气体的密度之比等于其摩尔质量之比,所以混合气体的摩尔质量为34g/mol,设n(NO)为x,n(NO2)为y,
混合气体摩尔质量=$\frac{30xg+46yg}{(x+y)mol}$=34g/mol,x:y=3:1,
故答案为:3:1;
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H1=-1160kJ/mol①
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574 kJ/mol②
根据盖斯定律,$\frac{1}{2}$(①-②)得:4NO(g)=2NO2(g)+N2(g)△H=-293 kJ/mol,
故答案为:4NO(g)=2NO2(g)+N2(g)△H=-293 kJ/mol;
(2)③B为负极,总反应式为CH4+2O2+=CO2+2H2O,正极反应式为:2O2+8e-=4O2-,两式相减,负极反应为:CH4-8e-+4O2-=CO2+2H2O,
故答案为:负;CH4-8e-+4O2-=CO2+2H2O;
④硫酸铜的物质的量=0.1L×1mol/L=0.1mol,开始阶段发生反应:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,铜离子完全放电后,发生反应2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,阳极的电极反应式:4OH--4e-=O2↑+2H2O;当两极收集到的气体体积相等时,即氢气与氧气的体积相等,令是氢气为xmol,根据电子转移守恒,则:0.1mol×2+2x=4x,解得x=0.1,根据电子转移守恒,可知消耗的甲烷物质的量=$\frac{0.1mol×4}{8}$=0.05mol,故消耗甲烷的体积=0.05mol×22.4L/mol=1.12L,原电池中发生反应时化学能不去全部转化为电能,即电池能量转化率达不到100%,所以实际上消耗的甲烷的体积比理论上大;
故答案为:4OH--4e-=O2↑+2H2O;1.12L;电池能量转化率达不到100%.
点评 本题考查了原电池和电解池工作原理、盖斯定律在热化学方程式计算中的应用,题目难度中等,明确原电池、电解池工作原理为解答关键,注意掌握盖斯定律的内容及应用方法.

 2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )
2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )| A. | 异胡薄荷醇遇FeCl3溶液显紫色 | |
| B. | 异胡薄荷醇可发生消去反应、加成反应 | |
| C. | 青蒿素分子中含有7个手性碳原子 | |
| D. | 青蒿素在热的酸、碱溶液中均可稳定存在 |
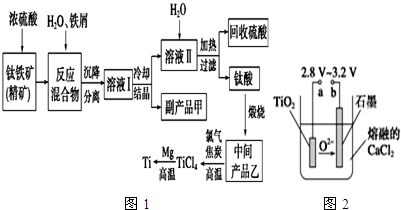
请回答下列问题.
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为FeTiO3;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为FeTiO3+2H2SO4═TiOSO4+FeSO4+2H2O
(2)上述生产流程中加入铁屑的目的是防止Fe2+氧化.此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如下表所示.
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为TiO2++2H2O═TiO(OH)2↓(或H2TiO3)+2H+).
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为TiO2+2C+2Cl2=TiCl4+2CO.Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是隔绝空气.除去所得金属钛中少量的金属镁可用的试剂是稀盐酸.
(4)在800~1 000℃时电解TiO2也可制得海绵钛,装置如图2所示.图中b是电源的正极,阴极的电极反应式为TiO2+4e-═Ti+2O2-.

已知:
①制取TiC14的反应原理为TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g)
②有关物质的性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,在550℃时能被氧气氧化 |
(1)仪器N的名称是圆底烧瓶,仪器A中盛装的试剂是碱石灰.
(2)检查装置气密性的方法是关闭止水夹K,在装置E中加入水浸没长导管下端,在水槽M中加入热水,装置E的长
导管口有气泡产生,移去水槽M,一段时间后,导管中形成一段水柱,则说明装置气密性
良好(或其他合理答案)
反应前通入N2的目的是排除装置中的空气,保证反应在无氧无水环境下进行
(3)装置B中热水的作用是使CCl4汽化.
(4)欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(5)TiC14还可由TiO2、焦炭和氯气在加热条件下反应制得,同时有气体生成,请设计实验方案探究气体中是否同时含有CO和CO2两种气体:将气体先通过澄清石灰水,干燥后再通人装有灼热Cu0的玻璃管中,若澄清石灰水变浑
浊且玻璃管中有红色固体生成,则气体中同时含有CO与C02两种气体(或其他合理答
案).
| A. | 铜与稀盐酸反应:Cu+2H +═Cu2 ++H2↑ | |
| B. | 小苏打与氢氧化钠溶液混 合:HCO3 -+OH -═CO2↑+H2 O | |
| C. | 氯化钙与碳酸氢钾溶液混合:Ca2 ++CO3 2 -═CaCO3↓ | |
| D. | CuSO4 与Ba(OH)2 溶液混合Cu2 ++SO4 2 -+2OH -+Ba2+═BaSO4↓+Cu(OH)2↓ |
| A. | 取用钠、钾、白磷时,没用完的药品要放回原瓶 | |
| B. | 用pH试纸测得氯水的pH为2 | |
| C. | 氯水、硝酸银溶液存放在配有磨口塞的棕色细口瓶中 | |
| D. | 金属钠着火时,用细沙覆盖灭火 |