题目内容
相同条件下,向等体积、pH=2的两种一元酸HA和HB的溶液中加入足量的镁粉,充分应后,收集到H2的体积前者大于后者,下列说法正确的是( )
| A、HA一定是强酸 |
| B、HB一定是强酸 |
| C、HB一定是弱酸 |
| D、反应开始时二者生成H2的速率相同 |
考点:弱电解质在水溶液中的电离平衡,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:相同条件下,向等体积、pH=2的两种一元酸HA和HB的溶液中加入足量的镁粉,充分应后,收集到H2的体积前者大于后者,说明HA最终电离出的氢离子浓度大于HB,则酸性HB>HA,据此分析解答.
解答:
解:相同条件下,向等体积、pH=2的两种一元酸HA和HB的溶液中加入足量的镁粉,充分应后,收集到H2的体积前者大于后者,说明HA最终电离出的氢离子浓度大于HB,则酸性HB>HA,
A.酸性HB>HA,所以HA一定是弱酸,故A错误;
B.根据已知条件无法确定HB的电离程度,则无法确定HB的酸性强弱,故B错误;
C.根据B知,无法确定HB的酸性强弱,故C错误;
D.反应速率与氢离子浓度成正比,pH相等时氢离子浓度相等,所以其开始反应速率相等,故D正确;
故选D.
A.酸性HB>HA,所以HA一定是弱酸,故A错误;
B.根据已知条件无法确定HB的电离程度,则无法确定HB的酸性强弱,故B错误;
C.根据B知,无法确定HB的酸性强弱,故C错误;
D.反应速率与氢离子浓度成正比,pH相等时氢离子浓度相等,所以其开始反应速率相等,故D正确;
故选D.
点评:本题考查弱电解质的电离,明确弱电解质电离特点是解本题关键,注意反应速率与氢离子浓度有关,与电解质强弱无关,为易错点.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
金属镍有广泛应用.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知氧化性Fe2+<Ni2+<Cu2+)( )
| A、阳极发生氧化反应,其主要电极反应式:Ni2++2e-═Ni |
| B、电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C、电解后,溶液中存在的金属阳离子有Fe2+,Zn2+和Ni2+ |
| D、电解后,电解槽底部的阳极泥中含有Cu,Pt和Fe |
关于用CCl4萃取碘水的 说法中不正确的是( )
| A、碘在CCl4中的溶解度大于在水中的溶解度 |
| B、萃取后水层颜色变浅 |
| C、萃取后CCl4溶液层为紫红色 |
| D、萃取后水层颜色变红且在下层 |
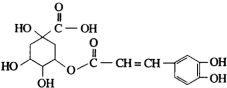 金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )
金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )| A、绿原酸的分子式为C16H8O9 |
| B、1mol绿原酸最多与7molNaOH反应 |
| C、1个绿原酸分子中含有4个手性碳原子 |
| D、绿原酸分子中有4种化学环境不同的氢原子 |
下列各组离子,在强酸性溶液中可以大量共存的是( )
| A、Na+、Ba2+、SO42- |
| B、Ag+、K+、NO3- |
| C、Ba2+、HCO3-、NO3- |
| D、Na+、NO3-、CO32- |
 1986年,瑞士两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的Nobel物理学奖.其晶胞结构如图.
1986年,瑞士两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的Nobel物理学奖.其晶胞结构如图. 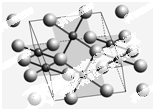 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.