题目内容
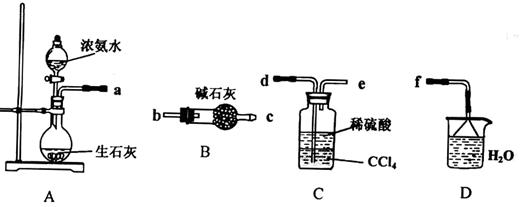
主要用于煤矿井下急救。某兴趣小组拟选用如下装置制备超氧化钾(部分夹持仪器已略去)。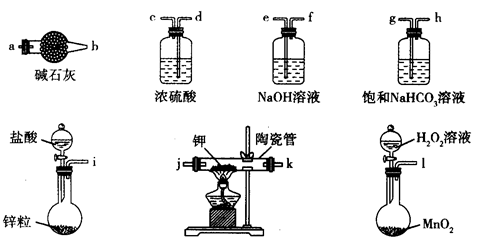
请回答下列问题:
(1)请选择必要的装置,按气流方向的连接顺序为_____________(填仪器接口的字母)。
(2)请根据完整的实验装置,完成下列实验步骤:①_____________________;②装入药品,打开分液漏斗活塞;③持续通入气体一段时间后,点燃酒精灯进行反应;④反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞;⑤拆除装置,取出产物。
(3)数据记录如下:
根据数据计算可得实验式KOx,则x=____________________。
(4)超氧化钾可吸收二氧化碳,并生成氧气,因此可以作为飞船、潜艇等密闭系统的氧气再生剂。写出超氧化钾与二氧化碳反应的化学方程式:__________________________。与过氧化钠相比,其优点是______________________________。
(1)lefdejka(jk可互换) (2分)
(2)检测装置的气密性(2分)
(3)1.75(2分)
(4)4KO2+2CO2=2K2CO3+3O2(2分)相同质量的过氧化钠和超氧化钾相比,朝氧化钾释放的氧气多。(2分)
解析试题分析:(1)根据超氧化钾(KO2),容易与空气中的水、二氧化碳等发生反应,因此制备的过程中一定要把装置所含的水和二氧化碳除去,进入到陶瓷管中的气体应先经过氢氧化钠溶液除二氧化碳,再经过浓硫酸干燥,陶瓷管后面也要接一个装有碱石灰的干燥管,防空气中的水和二氧化碳与超氧化钾接触,故顺序为:lefdejka(jk可互换);(2) 第一步应为检查装置的气密性;(3)钾的物质的量为:(15.19-14.80)/39=0.01mol,氧的物质的量=(15.47-5.19)/16=0.175mol,所以X=0.175mol/0.01mol=1.75;(4)过氧化钠与CO2反应的方程式为2Na2O2+2CO2=2NaCO3+O2,KO2与CO2反应的方程式为4KO2+2CO2=2K2CO3+3O2,故其优点是相同质量的过氧化钠和超氧化钾相比,朝氧化钾释放的氧气多。
考点:考查氧化还原反应及计算、化学实验基本操作等知识点。

(18分)甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计了如下实验流程:
实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装 置,立即加热氧化铜。反应完成后,黑色氧化铜转化为红色的铜。下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
甲小组测得:反应前氧化铜的质量m1 g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L。乙小组测得:洗气前装置D的质量m3g、洗气后装置D的质量为m4g、生成氮气在标准状况下的体积V2L。请回答下列问题:
(1)检查A装置气密性的操作是____________________________________________________。
(2)实验室检验氨气的操作和现象是____________________________________。
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备制备原理填写在下表的空格中。
| | 实验装置 | 实验药品 | 制备原理 |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为____________ |
| 乙小组 | _____ | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用:_______ |
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数之比明显小于理论值,其原因是_______。为此,乙小组在原有实验的基础上增加了一个装有某药晶的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氮气的体积,得出了合理的实验结果。该药品的名称是________。
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
①写出该反应的离子方程式_________________________;
②下列收集Cl2的装置正确装置是_________________________;
③将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是________________________;
④设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,____________
_______________________________________________________________________________________。
(2)某化学兴趣小组为了探究AgNO3的热稳定性,设计了如下实验。
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。
①装置B的作用是___________________________。
②经小组讨论并验证该无色气体为O2,其验证方法是_____________________。
【查阅资料】Ag2O和粉末的Ag均为黑色;Ag2O可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:i Ag;ii Ag2O;iii Ag和Ag2O
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验。
【实验评价】根据上述实验,不能确定固体产物成分的实验是___________(填实验编号)。
【实验结论】根据上述实验结果,该小组得出的AgNO3固体热分解的化学方程式为④______________________________。
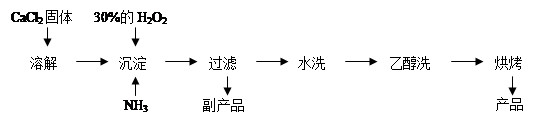
亚铁盐中,FeSO4?7H2O露置于空气中易被氧气氧化,而莫尔盐[(NH4)2SO4?FeSO4?6H2O]露置于空气中不易被氧气氧化,是一种重要的定量分析试剂。其制备原理是:FeSO4+(NH4)2SO4+6H2O =(NH4)2SO4?FeSO4?6H2O。
实验室用废铁屑制备莫尔盐的过程如下:
(1)步骤I除锈的操作是:将废铁屑放入烧杯, ,过滤,洗涤。
(2)步骤II铁屑的溶解在锥形瓶中进行,并水浴加热到60℃左右,需要的仪器是铁架台、石棉网、大烧杯、 。
(3)步骤III中加入的(NH4)2SO4与溶液中FeSO4的物质的量需满足的关系为:n[(NH4)2SO4]∶n[FeSO4]= 。
为了确定(NH4)2SO4的用量,下列方法简便可行的是 (填编号)。
A.称量废铁屑的质量,推算所需(NH4)2SO4的质量
B.称量无锈铁屑和步骤II之后剩余铁屑的质量,推算所需(NH4)2SO4的质量
C.测定FeSO4溶液的浓度和体积,推算所需(NH4)2SO4的质量
(4)所得晶体样品中可能混有的杂质是FeSO4·7H2O和(NH4)2SO4中的一种。某小组设计了如下方案进行检验和测定,请在答题卡上完成表中内容。
| 序号 | 实验方案 | 实验现象和结论 |
| 步骤1 | 取少量样品 | 样品颜色可能有变化。 |
| 步骤2 | 步骤1后将样品转移到试管中,加入去氧蒸馏水,振荡溶解,调节至酸性,________ ___________ __ 。 | 若 ,说明样品中含有FeSO4·7H2O杂质。 |
| 步骤3 | 若步骤2证明样品不含FeSO4?7H2O杂质,再另取样品测定其中NH4+的质量分数w1与理论值w2比较。 | 若w1 w2,说明样品中含有(NH4)2SO4杂质。 |
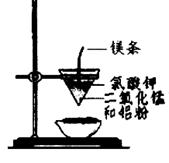
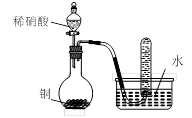
用下图所示装置进行实验,不能达到实验目的的是:( )
甲 乙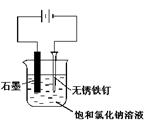
丙 丁
| A.用甲装置比较硫、碳、硅三种元素的非金属性强弱 |
| B.用乙装置可制得金属锰,用同样的装置可制得金属铬 |
| C.用丙装置可实现对铁钉的保护 |
| D.用丁装置验证铜与稀硝酸反应的气体产物只有NO |