题目内容
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
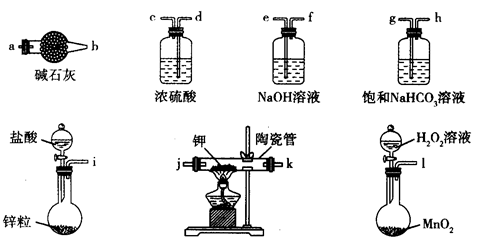
(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
①写出该反应的离子方程式_________________________;
②下列收集Cl2的装置正确装置是_________________________;
③将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是________________________;
④设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,____________
_______________________________________________________________________________________。
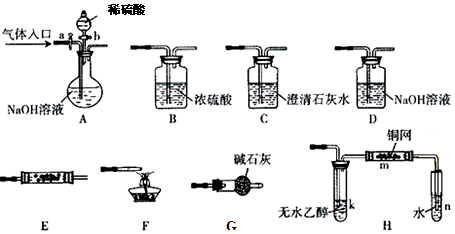
(2)某化学兴趣小组为了探究AgNO3的热稳定性,设计了如下实验。
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。
①装置B的作用是___________________________。
②经小组讨论并验证该无色气体为O2,其验证方法是_____________________。
【查阅资料】Ag2O和粉末的Ag均为黑色;Ag2O可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:i Ag;ii Ag2O;iii Ag和Ag2O
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验。
【实验评价】根据上述实验,不能确定固体产物成分的实验是___________(填实验编号)。
【实验结论】根据上述实验结果,该小组得出的AgNO3固体热分解的化学方程式为④______________________________。
(共12分)(1) ① MnO2+4H+ + 2Cl― Mn2++ Cl2↑+2H2O (1分)
Mn2++ Cl2↑+2H2O (1分)
② C (1分) ③ Cl2 、HClO 、 ClO―(2分)
④ 用胶头滴管向试管中滴加溴化钠溶液、震荡使其充分反应,发现溶液出现分层现象,下层溶液变为橙色(2分)
(2)①防止倒吸(1分) ②用带火星的小木条插入集气瓶内,木条复燃,证明无色气体为O2(1分)
③ b (2分) ④ 2AgNO3 2Ag + 2NO2 + O2↑(2分)
2Ag + 2NO2 + O2↑(2分)
解析试题分析:(1)①实验室中用浓盐酸与MnO2共热制取Cl2,反应的离子方程式为MnO2+4H+ + 2Cl― Mn2++ Cl2↑+2H2O。
Mn2++ Cl2↑+2H2O。
②氯气能溶于水,且能和氢氧化钠溶液反应,所以不能用排水发收集氯气。又因为氯气的大于空气的,且氯气有毒,需要尾气处理,因此正确的答案选C。
③将Cl2通入水中,部分氯气与水反应生成次氯酸,次氯酸具有强氧化性。又因为次氯酸是弱酸,能电离出ClO-,所以所得溶液中具有氧化性的含氯粒子是Cl2 、HClO、ClO―。
④非金属性强的单质可以将非金属性弱的单质从其盐溶液中中转换出来,据此可以比较非金属性强弱。即取少量新制氯水和CCl4于试管中,用胶头滴管向试管中滴加溴化钠溶液、震荡使其充分反应,发现溶液出现分层现象,下层溶液变为橙色,这就说明Cl2的氧化性强于Br2的氧化性。
(2)①红棕色气体是NO2,NO2极易被氢氧化钠溶液吸收,所以B装置的作用是防止倒吸。
②O2是助燃性气体,其验证方法是用带火星的小木条插入集气瓶内,木条复燃,证明无色气体为O2。
③a实验中,加入足量氨水,振荡黑色固体不溶解,说明黑色固体应该是银;b实验中,加入足量稀硝酸,振荡黑色固体溶解,可能有Ag或者Ag2O。有气体产生证明有Ag ,所以不能证明确定有Ag2O,因此不能确定固体产物成分的实验是b。
④根据上述实验结果可知,硝酸银分解生成单质银、氧气和NO2,所以AgNO3固体热分解的化学方程式为2AgNO3 2Ag + 2NO2 + O2↑。
2Ag + 2NO2 + O2↑。
考点:考查氯气、收集、性质、非金属性强弱比较以及硝酸银分解产物的实验探究等

实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为:_ ;为了吸收该反应中产生的尾气,应选择下列装置(填字母)。
(2)为符合绿色化学的要求,某研究性学习小组设计了如下两种方案:
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通人到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp(Cu(OH)2]=10-22, Ksp[Fe(OH)2]=10-16,Ksp[Fe(OH)3]=10-38
请回答下列问题:
①方案1中的B仪器名称是_。
②为了使铁元素全部沉淀,应调节pH至少为_。
③方案2中甲物质可选用的是_。
| A.CaO | B.NaOH | C.CuCO3 | D.Cu2(OH)2CO3 E. Fe2(SO4)3 |
实验室制备1,2-二溴乙烷的反应原理如下:
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示: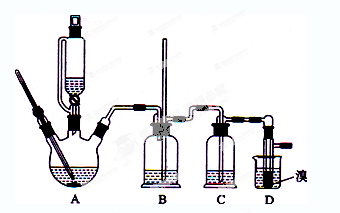
有关数据列表如下:
| | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用 的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
下列关于各实验装置图的叙述中正确的是( )

| A.装置①:构成锌—铜原电池 |
| B.装置②:除去Cl2中含有的少量HCl |
| C.装置③:验证溴乙烷发生消去反应生成烯烃 |
| D.装置④:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH |