题目内容
【题目】某有机化合物的结构简式如图所示,下列说法不正确的是( )
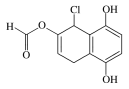
A.能发生银镜发应
B.能与FeCl3溶液发生显色反应
C.1 mol该物质最多可与4 mol NaOH反应
D.与NaHCO3、Na2CO3溶液均能发生反应
【答案】D
【解析】
A. 该有机物分子中含有醛基,因此能够发生银镜反应,A正确;
B. 该有机物分子中含有酚羟基,能与FeCl3溶液发生显色反应,B正确;
C. 该有机物分子中含有2个酚羟基,1个酯基、1个Cl原子,Cl原子水解后得到1个醇羟基和1个HCl,醇羟基不能与NaOH发生反应,甲酸形成的酯基水解得到甲酸和1个醇羟基;酚羟基、甲酸中的羧基和HCl都可以与NaOH发生反应,它们反应时的物质的量的比是1:1,因此1 mol该物质最多可与4 mol NaOH反应,C正确;
D. 由于酸性:H2CO3>苯酚>HCO3-,所以该物质只能与Na2CO3发生反应,不能与NaHCO3反应,D错误;
故合理选项是D。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次从左至右发生的反应类型和反应条件都正确的是 ( )
选项 | 反应类型 | 反应条件 |
A | 加成反应;取代反应;消去反应 | KOH醇溶液 |
B | 消去反应;加成反应;取代反应 | NaOH水溶液 |
C | 氧化反应;取代反应;消去反应 | 加热;KOH醇溶液 |
D | 消去反应;加成反应;水解反应 | NaOH醇溶液 |
A.AB.BC.CD.D
【题目】某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(已知H2C2O4是弱酸)
实验 序号 | 实验 温度 | KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪色时间 | ||
V(mL) | c(mol/L) | V(mL) | c(mol/L) | V(mL) | t(s) | ||
A | 293K | 2 | 0.05 | 8 | 0.25 | 0 | t1 |
B | T1 | 2 | 0.05 | 6 | 0.25 | V1 | 8 |
C | 313K | 2 | 0.05 | 6 | 0.25 | 2 | t2 |
(1)通过实验A、B,可探究出___的改变对反应速率的影响,其中
(2)通过实验____可探究出温度变化对化学反应速率的影响。
(3)若t1<8,则由实验A、B可以得出的结论是____;利用实验B中数据计算,从反应开始到有结束,用KMnO4的浓度变化表示的反应速率为______。
(4)该反应中有无色无味气体产生,且锰被还原为Mn2+,写出相应反应的离子方程式 ________。
(5)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是 ____。