题目内容
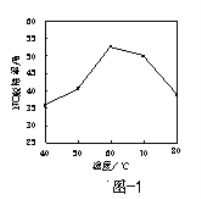
【题目】将H2和CO以![]() =2的方式充入1 L的恒容密闭容器中,一定条件下发生反应:4H2(g)+2CO(g)
=2的方式充入1 L的恒容密闭容器中,一定条件下发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),测得CO的平衡转化率随温度、压强变化关系如图所示。下列说法正确的是
CH3OCH3(g)+H2O(g),测得CO的平衡转化率随温度、压强变化关系如图所示。下列说法正确的是
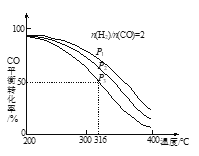
A.该反应的△H<0
B.压强大小:P1<P2<P3
C.在316℃时,该反应的平衡常数为0.25
D.若在P3和316℃时,起始时![]() =3,则达到平衡时,CO转化率大于50%
=3,则达到平衡时,CO转化率大于50%
【答案】AD
【解析】
A.根据题图可以看出当压强一定时,温度越高转化率越低,即温度升高平衡逆向移动,则正反应放热,A项正确;
B.当温度一定时,可以看出p1的转化率最高,正反应是气体分子数减小的反应,因此压强越大转化率应该越大,故p1>p2>p3,B项错误;
C.压强不确定,CO平衡转化率未知,起始时反应物的物质的量也未知,无法计算平衡常数,C项错误;
D.有两种气体反应物A、B参加反应时,若增加A的起始浓度,则可以提高B的转化率,D项正确;
答案选AD。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向KI溶液中滴入少量新制氯水和四氯化碳,振荡、静置,溶液下层呈紫红色 | I的还原性强于Cl |
B | 向无水乙醇中加入浓H2SO4,加热,将产生的气体通入酸性KMnO4溶液,紫红色褪去 | 该气体一定是乙烯 |
C | 测定Na2CO3和Na2SiO3溶液的pH,后者pH比前者的大 | C的非金属性比Si强 |
D | 向1-溴丙烷中加入KOH溶液,加热几分钟,冷却后再加入AgNO3溶液,无淡黄色沉淀生成 | 1-溴丙烷没有水解 |
A.AB.BC.CD.D
【题目】一定温度时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应: PCl5(g) ![]() Cl2(g)+PCl3(g)经一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
Cl2(g)+PCl3(g)经一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
反应时间/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
(1)能表明该反应达到平衡状态的是________(填序号);
A.生成1molPCl3的同时生成1molPCl5 B.混合气体的平均相对分子质量不变
C.PCl5、Cl2、PCl3三者的浓度比值1:1:1 D.混合气体的密度不变
(2)上述温度下,达到平衡时,PCl5的转化率为____;该反应的平衡常数K= ___。
(3)反应在前50 s内的平均速率为v(PCl3)=_____。
(4)保持其他条件不变,若升高温度,反应重新达到平衡,平衡时c(PCl3)=0.11moI·L-l,则正反应的ΔH__0(填“>”或“<”)。
(5)相同温度下,若起始时向容器中充入1.0 molPCl5、0.20mol PCl3和0.20 mol Cl2,则反应达到平衡前v(正) __ v(逆)(填“>”或“<”)