题目内容
15.下列选项的化合物中,在常温、常压下以液态形式存在的是( )| A. | 丙烷 | B. | 乙炔 | C. | 乙烯 | D. | 乙醇 |
分析 常见有机物中常温下为气态有:C原子数≤4烃、新戊烷、一氯甲烷、甲醛等,据此判断.
解答 解:乙炔、丙烯、乙烯是碳原子数小于等于4的烃,呈气态,乙醇在常温常压下以液态形式存在,故选D.
点评 本题主要考查了物质的状态,抓住规律是解题的关键.

练习册系列答案
相关题目
5.下列实验不能达到预期目的是( )
| A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
| B | MgCl2、Al Cl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
| C | NaCO3溶液中加入稀H2SO4 | 比较碳、硫的非金属性强弱 |
| D | Fe、Cu分别与盐酸反应 | 比较铁、铜的金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
6.下列有机物的命名正确的是( )
| A. | 二溴乙烷: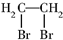 | B. | 3-乙基-1-丁烷: | ||
| C. | 2,2,3-三甲基戊烷: | D. | 2-甲基-2,4-己二烯: |
20.下列物质中不属于有机物的是( )
| A. | 甲酸 | B. | 碳酸钙 | C. | 甲苯 | D. | 乙炔 |
7.下列关于硅和硅的化合物性质的叙述,正确的是( )
| A. | 二氧化硅是酸性氧化物,不跟任何酸起反应 | |
| B. | 二氧化硅的化学键是共价键,可溶于水制得硅酸 | |
| C. | 根据CO2通入水玻璃中可制得硅酸,可知碳酸的酸性比硅酸强 | |
| D. | 硅在常温下能跟氢气起反应生成SiH4 |
4.现有部分短周期元素的原子结构如表:
(1)写出X的元素符号:N,元素Y的最简单氢化物的化学式为CH4.
(2)Z元素原子的质量数为23.
(3)X和Z两种元素的最高价氧化物对应的水化物相互反应的离子方程式为H++OH-=H2O.
(4)Y和Z两种元素的最高价氧化物发生氧化还原反应的化学方程式2CO2+2Na2O2=2Na2CO3+O2
(5)W、X、Y、Z为短周期内除稀有气体元素外的四种元素.它们的原子序数依次增大,其中只有Y是金属元素,Y的最外层电子数和W最外层电子数相等,Y、Z两元素的质子数之和为W、X两元素的质子数之和的3倍.由此可知元素W为H;X为O;Y 为Na;Z为S.上述元素中任意三种可组成盐,写出这些盐的化学式Na2SO4、Na2SO3、Na2S2O3、NaHS.
| 元素符 号 | 元素原子结构 |
X | 原子结构示意图为 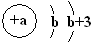 |
| Y | 最外层电子数是次外层电子数的2倍 |
Z | 原子核内含有12个中子,且其离子的结构示意图为  |
(2)Z元素原子的质量数为23.
(3)X和Z两种元素的最高价氧化物对应的水化物相互反应的离子方程式为H++OH-=H2O.
(4)Y和Z两种元素的最高价氧化物发生氧化还原反应的化学方程式2CO2+2Na2O2=2Na2CO3+O2
(5)W、X、Y、Z为短周期内除稀有气体元素外的四种元素.它们的原子序数依次增大,其中只有Y是金属元素,Y的最外层电子数和W最外层电子数相等,Y、Z两元素的质子数之和为W、X两元素的质子数之和的3倍.由此可知元素W为H;X为O;Y 为Na;Z为S.上述元素中任意三种可组成盐,写出这些盐的化学式Na2SO4、Na2SO3、Na2S2O3、NaHS.
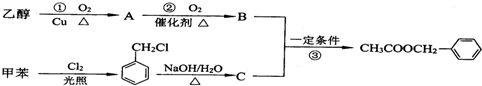
 +CH3COOH$→_{△}^{浓硫酸}$
+CH3COOH$→_{△}^{浓硫酸}$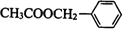 +H2O.
+H2O.