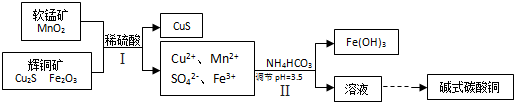
��Ŀ����
��ͭ����ұ��ͭ����Ҫԭ�ϣ�
��1����ҵ��ұ����ͭ��ij�ַ�ӦΪ��Cu2S+O2�T2Cu+SO2
�ٵ����������11.2L����ʱ��ת�Ƶ�����ĿΪ ��
�ڽ���ͭ���е�⾫������ͭӦ�����Դ�� ����ӣ�������ij�ֽ�������п�Ĵ�ͭ��ͨ��һ��ʱ�������������ag���������Һ����bg�����ͭ�к�п����������Ϊ ��
��2������ͭ�����̿������´����������Ƶü�ʽ̼��ͭ��
��ͭ���ʷ����ڳ�ʪ�����У��������ɼ�ʽ̼��ͭ����Ӧ��ѧ����ʽ�� ��
�ڲ�����У�̼����鱗��뷴Ӧ�����ӷ���ʽΪ ��
�۲�����з�������3����Ӧ����֪��Ӧi�������ɵ�������������ã���д����Ӧ���Ļ�ѧ����ʽ��
��Fe2O3+3H2SO4�TFe2��SO4��3+3H2O
��Cu2S+Fe2��SO4��3�TCuSO4+CuS+2FeSO4
��
�ܲ�����е���pH�����Һ�У�ͭ����Ũ������ܳ��� mol?L-1������֪Ksp[��Cu��OH��2��]=2��10-a��
��1����ҵ��ұ����ͭ��ij�ַ�ӦΪ��Cu2S+O2�T2Cu+SO2
�ٵ����������11.2L����ʱ��ת�Ƶ�����ĿΪ
�ڽ���ͭ���е�⾫������ͭӦ�����Դ��
��2������ͭ�����̿������´����������Ƶü�ʽ̼��ͭ��

��ͭ���ʷ����ڳ�ʪ�����У��������ɼ�ʽ̼��ͭ����Ӧ��ѧ����ʽ��
�ڲ�����У�̼����鱗��뷴Ӧ�����ӷ���ʽΪ
�۲�����з�������3����Ӧ����֪��Ӧi�������ɵ�������������ã���д����Ӧ���Ļ�ѧ����ʽ��
��Fe2O3+3H2SO4�TFe2��SO4��3+3H2O
��Cu2S+Fe2��SO4��3�TCuSO4+CuS+2FeSO4
��
�ܲ�����е���pH�����Һ�У�ͭ����Ũ������ܳ���
���㣺���ԭ��,�Ʊ�ʵ�鷽�������
ר�⣺ʵ�������,�绯ѧר��
��������1���ٸ��ݵ����غ���ת�Ƶ�����Ŀ��
�ڽ���ͭ���е�⾫������ͭӦ�����Դ��������ӣ�������ij�ֽ�������п�Ĵ�ͭ��ͨ��һ��ʱ�������������ag�����ӵ�������Ϊ������ͭ���������Һ����bg����μӷ�Ӧ��п��ͭ�������ֱ���mg��ng����m+n-a=b�����ݵ����غ��֪
+
=
�����m=65b�����ͭ�к�п����������Ϊ
=
��
��2����ͭ���ʷ����ڳ�ʪ�����У�������������ˮ��������̼�Ƚ�����ɼ�ʽ̼��ͭΪ���⣬��Ӧ��ѧ����ʽ��2Cu+O2+CO2+H2O=Cu2��OH��2CO3��
�ڲ�����ǵ�����ҺpH�ģ����̼������������ӷ�Ӧ����Ӧ�����ӷ���ʽΪHCO3-+H+=H2O+CO2����
��������������ã���ڶ��������ɵ�����������Ҫ�ڵ����������±�������������������˷�Ӧ�Ļ�ѧ����ʽΪMnO2+2FeSO4+2H2SO4=MnSO4+Fe2��SO4��3+2H2O��
����Һ��pH=3.5������Һ��������Ũ����10-10.5mol/L�����Ը���������ͭ���ܶȻ�������֪��ͭ���ӵ�Ũ�Ȳ��ܳ���
=2��1021-a mol/L��
�ڽ���ͭ���е�⾫������ͭӦ�����Դ��������ӣ�������ij�ֽ�������п�Ĵ�ͭ��ͨ��һ��ʱ�������������ag�����ӵ�������Ϊ������ͭ���������Һ����bg����μӷ�Ӧ��п��ͭ�������ֱ���mg��ng����m+n-a=b�����ݵ����غ��֪
| m |
| 65 |
| n |
| 64 |
| a |
| 64 |
| 65b |
| m+n |
| 65a |
| a+b |
��2����ͭ���ʷ����ڳ�ʪ�����У�������������ˮ��������̼�Ƚ�����ɼ�ʽ̼��ͭΪ���⣬��Ӧ��ѧ����ʽ��2Cu+O2+CO2+H2O=Cu2��OH��2CO3��
�ڲ�����ǵ�����ҺpH�ģ����̼������������ӷ�Ӧ����Ӧ�����ӷ���ʽΪHCO3-+H+=H2O+CO2����
��������������ã���ڶ��������ɵ�����������Ҫ�ڵ����������±�������������������˷�Ӧ�Ļ�ѧ����ʽΪMnO2+2FeSO4+2H2SO4=MnSO4+Fe2��SO4��3+2H2O��
����Һ��pH=3.5������Һ��������Ũ����10-10.5mol/L�����Ը���������ͭ���ܶȻ�������֪��ͭ���ӵ�Ũ�Ȳ��ܳ���
| 2��10-a |
| (10-10.5)2 |
���
�⣺��1���ٸ��ݷ�ӦCu2S+O2=2Cu+SO2��֪����Ӧ����Ԫ�ػ��ϼۺ�ͭԪ�ػ��ϼ۽��ͣ�ֻ����Ԫ�صĻ��ϼ۴�-2�����ߵ�+4�ۣ�ʧȥ6�����ӣ����Ե����������11.2L���弴0.5mol��������ʱ��ת�Ƶ������ʵ�����0.5mol��6=3mol������ĿΪ3NA���ʴ�Ϊ��3NA��
�ڽ���ͭ���е�⾫������ͭӦ�����Դ��������ӣ�������ij�ֽ�������п�Ĵ�ͭ��ͨ��һ��ʱ�������������ag�����ӵ�������Ϊ������ͭ���������Һ����bg����μӷ�Ӧ��п��ͭ�������ֱ���mg��ng����m+n-a=b�����ݵ����غ��֪
+
=
�����m=65b�����ͭ�к�п����������Ϊ
=
��
�ʴ�Ϊ������
��
��2����ͭ���ʷ����ڳ�ʪ�����У�������������ˮ��������̼�Ƚ�����ɼ�ʽ̼��ͭΪ���⣬��Ӧ��ѧ����ʽ��2Cu+O2+CO2+H2O=Cu2��OH��2CO3��
�ʴ�Ϊ��2Cu+O2+CO2+H2O=Cu2��OH��2CO3��
�ڲ�����ǵ�����ҺpH�ģ����̼������������ӷ�Ӧ����Ӧ�����ӷ���ʽΪHCO3-+H+=H2O+CO2�����ʴ�Ϊ��HCO3-+H+=H2O+CO2����
��������������ã���ڶ��������ɵ�����������Ҫ�ڵ����������±�������������������˷�Ӧ�Ļ�ѧ����ʽΪMnO2+2FeSO4+2H2SO4=MnSO4+Fe2��SO4��3+2H2O���ʴ�Ϊ��MnO2+2FeSO4+2H2SO4=MnSO4+Fe2��SO4��3+2H2O��
����Һ��pH=3.5������Һ��������Ũ����10-10.5mol/L�����Ը���������ͭ���ܶȻ�������֪��ͭ���ӵ�Ũ�Ȳ��ܳ���
=2��1021-a mol/L��
�ʴ�Ϊ��2��1021-a��
�ڽ���ͭ���е�⾫������ͭӦ�����Դ��������ӣ�������ij�ֽ�������п�Ĵ�ͭ��ͨ��һ��ʱ�������������ag�����ӵ�������Ϊ������ͭ���������Һ����bg����μӷ�Ӧ��п��ͭ�������ֱ���mg��ng����m+n-a=b�����ݵ����غ��֪
| m |
| 65 |
| n |
| 64 |
| a |
| 64 |
| 65b |
| m+n |
| 65a |
| a+b |
�ʴ�Ϊ������
| 65a |
| a+b |
��2����ͭ���ʷ����ڳ�ʪ�����У�������������ˮ��������̼�Ƚ�����ɼ�ʽ̼��ͭΪ���⣬��Ӧ��ѧ����ʽ��2Cu+O2+CO2+H2O=Cu2��OH��2CO3��
�ʴ�Ϊ��2Cu+O2+CO2+H2O=Cu2��OH��2CO3��
�ڲ�����ǵ�����ҺpH�ģ����̼������������ӷ�Ӧ����Ӧ�����ӷ���ʽΪHCO3-+H+=H2O+CO2�����ʴ�Ϊ��HCO3-+H+=H2O+CO2����
��������������ã���ڶ��������ɵ�����������Ҫ�ڵ����������±�������������������˷�Ӧ�Ļ�ѧ����ʽΪMnO2+2FeSO4+2H2SO4=MnSO4+Fe2��SO4��3+2H2O���ʴ�Ϊ��MnO2+2FeSO4+2H2SO4=MnSO4+Fe2��SO4��3+2H2O��
����Һ��pH=3.5������Һ��������Ũ����10-10.5mol/L�����Ը���������ͭ���ܶȻ�������֪��ͭ���ӵ�Ũ�Ȳ��ܳ���
| 2��10-a |
| (10-10.5)2 |
�ʴ�Ϊ��2��1021-a��
���������⿼�������ʷ����ᴿ�ķ��������̷���Ӧ�ã���Ҫ���������ʵ����⣬���ջ����ǹؼ�����Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
��֪������KMnO4��Һ�еμ�Ũ���ᣬ��������ɫ���壻 ����KBr��Һ��ͨ������ʵ��ٲ��������壬��Һ���ɫ�� ��ȡʵ������ɵ���Һ��������FeCl2��KSCN�Ļ����Һ�У���Һ��Ѫ��ɫ����������ʵ�飬�����ж���ȷ���ǣ�������
| A������ʵ���У���������������ԭ��Ӧ |
| B������ʵ��֤����ԭ�ԣ�Fe2+��Br-��Cl-��Mn2+ |
| C��ʵ������ɵ����岻��ʹʪ��ĵ���KI��ֽ���� |
| D��ʵ���֤��Fe2+�������������л�ԭ�� |
�Ե�������п��������ӻ�˥�ϡ����ʽ�֬�ȹ�Ч�����Ľṹ��ʽΪ��
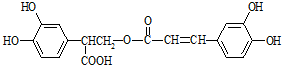 �����ڱ�����Ϊԭ�Ϻϳ��Ե������·��Ϊ��
�����ڱ�����Ϊԭ�Ϻϳ��Ե������·��Ϊ��
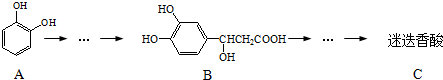
����˵����ȷ���ǣ�������
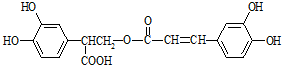 �����ڱ�����Ϊԭ�Ϻϳ��Ե������·��Ϊ��
�����ڱ�����Ϊԭ�Ϻϳ��Ե������·��Ϊ��
����˵����ȷ���ǣ�������
| A���л���A����������ԭ��һ����ͬһƽ���� |
| B���л���C��Ũ�������ˮ���һ�ֲ�����B |
| C���л���B���Է���ȡ�����ӳɡ���ȥ��������Ӧ |
| D��1 mol�Ե�����ֱ���������NaOH��Һ��Ũ��ˮ��Ӧ����������NaOH��Br2��Ϊ6 mol |
����ɫ����Һ�У��ܴ���������������ǣ�������
| A��Cu2+��Na+��SO42-��Cl- |
| B��K+��Na+��HCO3-��NO3- |
| C��OH-��HCO3-��Ca2+��Na+ |
| D��Ba2+��Na+��OH-��NO3- |
��2NO2������ɫ��?N2O4����ɫ���Ŀ��淴Ӧ�У�����״̬һ���ﵽ��ѧƽ��״̬���ǣ�������
| A��N2O4��NO2�ķ�������Ϊ1��2 |
| B��N2O4��NO2��Ũ����� |
| C����λʱ����1 mol N2O4���ĵ�ͬʱ��2 mol NO2���� |
| D��ƽ����ϵ����ɫ���ٸı� |
