题目内容
9.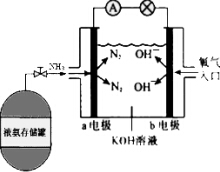 氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,回答下列问题.
氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,回答下列问题.(1)a电极的电极反应式为2NH3-6e-+6OH-═N2+6H2O;
(2)反应一段时间后,电解质溶液的pH将减小(填“增大”“减小”或“不变”).
分析 (1)燃料电池中,负极上是燃料氨发生失电子的氧化反应;
(2)根据电极反应式结合氢离子和氢氧根离子浓度的变化来确定溶液pH的变化.
解答 解:(1)a电极通入的是氨气,为负极,负极上燃料氨气失电子发生氧化反应,电极反应式为:2NH3-6e-+6OH-═N2+6H2O,
故答案为:2NH3-6e-+6OH-═N2+6H2O;
(2)反应一段时间后,由于电池反应生成水,所以电解质中氢氧根浓度减小,即碱性减弱,pH减小,
故答案为:减小.
点评 本题考查了原电池原理的应用,题目主要考查了燃料电池,侧重于电极反应式书写内容的考查,题目难度不大,注意燃料电池中根据得失电子判断正负极.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
4.现有以下8种物质:a.铝、b.NaHSO4固体、c.氯化氢、d.SO2、e.Ba(OH)2固体,f.K2co3固体、g.稀硫酸、h.熔融NaNO3
(1)按物质的分类方法填写表格的空白处(填编号)
(2)e与g在水溶液中反应的离子方程式为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O.
(1)按物质的分类方法填写表格的空白处(填编号)
| 分类标准 | 能导电的物质 | 电解质 | 能电离出H+的物质 |
| 属于该类的物质 | a、g、h | b、c、e、f、h | b、c、g |
4.甲、乙、丙、丁四种易溶于水的物质,分别有NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成.
已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;
②0.1mol/L 乙溶液的pH<1(在常温下);
③向丙溶液中滴入AgNO3溶液,有不溶于稀硝酸的白
色沉淀生成.下列结论不正确的是( )
已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;
②0.1mol/L 乙溶液的pH<1(在常温下);
③向丙溶液中滴入AgNO3溶液,有不溶于稀硝酸的白
色沉淀生成.下列结论不正确的是( )
| A. | 甲溶液中含有HCO3- | B. | 乙溶液中含有SO42- | ||
| C. | 丙溶液中含有Mg2+ | D. | 丁溶液中含有NH4+ |
19.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 28 g氮气所含有的原子数目为NA | |
| B. | 在常温常压下,11.2 L N2含有的分子数为0.5 NA | |
| C. | 0.5 mol单质铁与足量盐酸反应转移电子数为NA | |
| D. | 标准状况下,1 L水所含分子数为$\frac{1}{22.4}$NA |
 第二周期中碳、氮、氧是构成生命物质的三种主要元素,在生产生活中也有着重要的应用.
第二周期中碳、氮、氧是构成生命物质的三种主要元素,在生产生活中也有着重要的应用.