题目内容
H2O2是一种常用绿色氧化剂,在化学研究中应用广泛.

(1)空气阴极法电解制备H2O2的装置如图1所示,主要原理是在碱性电解质溶液中,通过利用空气中氧气在阴极还原得到H2O2和稀碱的混合物.试回答:
①直流电源的a极名称是 .
②阴极电极反应式为 .
③1979年,科学家们用CO、O2和水在三苯膦钯的催化下室温制得了H2O2.相对于电解法,该
方法具有的优点是安全、 .
(2)Fe3+对H2O2的分解具有催化作用.利用图2(a)和(b)中的信息,按图2(c)装置(连通的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),其原因是 .
(3)用H2O2 和H2SO4 的混合溶液可溶解印刷电路板金属粉末中的铜.反应的离子方程式是 ,控制其它条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol?L-1H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是 .

(1)空气阴极法电解制备H2O2的装置如图1所示,主要原理是在碱性电解质溶液中,通过利用空气中氧气在阴极还原得到H2O2和稀碱的混合物.试回答:
①直流电源的a极名称是
②阴极电极反应式为
③1979年,科学家们用CO、O2和水在三苯膦钯的催化下室温制得了H2O2.相对于电解法,该
方法具有的优点是安全、
(2)Fe3+对H2O2的分解具有催化作用.利用图2(a)和(b)中的信息,按图2(c)装置(连通的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的
(3)用H2O2 和H2SO4 的混合溶液可溶解印刷电路板金属粉末中的铜.反应的离子方程式是
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| Cu的平均溶解速率 (×10-3mol?min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
考点:电解原理,过氧化氢
专题:
分析:(1)由题给信息氧气在阴极还原得到H2O2和稀碱的混合物,则b为负极,a为正极;电解法需消耗电能,而催化法常温下即可进行;
(2)由图a可知,1mol过氧化氢总能量高于1mol水与0.5mol氧气总能量,故过氧化氢分解是放热反应,由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动;
(3)溶液变成蓝色,铜被氧化成铜离子:Cu+H2O2+H2SO4
CuSO4+2H2O;当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是:温度高于40℃后,随着温度的升高,H2O2的分解速率加快,使溶液中H2O2的浓度降低加快,对铜的溶解速率的影响超过了温度升高对铜溶解速率的影响,所以铜的溶解速率逐渐减小.
(2)由图a可知,1mol过氧化氢总能量高于1mol水与0.5mol氧气总能量,故过氧化氢分解是放热反应,由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动;
(3)溶液变成蓝色,铜被氧化成铜离子:Cu+H2O2+H2SO4
| ||
解答:
解:(1)由题给信息氧气在阴极还原得到H2O2和稀碱的混合物,则b为负极,a为正极,阴极电极反应式为:O2+2e-+2H2O=H2O2+2OH-,电解需要消耗大量电能,而CO、O2和水在三苯膦钯的催化下室温制得了H2O2,不需要额外提供能量,故答案为:正极;O2+2e-+2H2O=H2O2+2OH-;能耗低;
(2)由图a可知,1mol过氧化氢总能量高于1mol水与0.5mol氧气总能量,故过氧化氢分解是放热反应,由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动,即向生成NO2移动,故B瓶颜色更深,
故答案为:深;H2O2分解放热,使平衡2NO2═N2O4向生成NO2方向移动;
(3)铜与H2O2 和H2SO4 反应生成了硫酸铜,反应方程式是:Cu+H2O2+H2SO4
CuSO4+2H2O;由于温度高于40℃后,随着温度的升高,H2O2的分解速率加快,使溶液中H2O2的浓度降低加快,对铜的溶解速率的影响超过了温度升高对铜溶解速率的影响,所以铜的溶解速率逐渐减小;
故答案为:Cu+H2O2+H2SO4
CuSO4+2H2O;温度高于40℃后,随着温度的升高,H2O2的分解速率加快,使溶液中H2O2的浓度降低加快,对铜的溶解速率的影响超过了温度升高对铜溶解速率的影响,所以铜的溶解速率逐渐减小.
(2)由图a可知,1mol过氧化氢总能量高于1mol水与0.5mol氧气总能量,故过氧化氢分解是放热反应,由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动,即向生成NO2移动,故B瓶颜色更深,
故答案为:深;H2O2分解放热,使平衡2NO2═N2O4向生成NO2方向移动;
(3)铜与H2O2 和H2SO4 反应生成了硫酸铜,反应方程式是:Cu+H2O2+H2SO4
| ||
故答案为:Cu+H2O2+H2SO4
| ||
点评:本题考查电解原理、反应速率影响因素、化学平衡移动等,侧重对学生综合能力的考查,需要学生具备扎实的基础,难度中等.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示.下列说法正确的是( )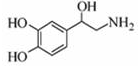

| A、每个去甲肾上腺素分子中含有3个酚羟基 |
| B、1mol去甲肾上腺素最多能与2molBr2 |
| C、甲肾上腺素分子不能与饱和的碳酸氢钠溶液发生反应 |
| D、去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 |
配制一定物质的量浓度的NaOH溶液时,造成实验结果偏低的是( )
| A、称重时发现砝码生锈 |
| B、定容时观察液面俯视 |
| C、有少量NaOH溶液残留在烧杯中 |
| D、容量瓶中原来有少量的蒸馏水 |
下列关于蛋白质的说法不正确的是( )
| A、重金属盐能使蛋白质变性,所以误食重金属盐时,可以喝牛奶解毒 |
| B、阿胶的主要成分是蛋白质,蚕丝的主要成份是纤维素 |
| C、蛋白质溶液中加入饱和硫酸铵溶液,蛋白质析出,再加水,重新溶解 |
| D、浓硝酸溅到皮肤上,会使皮肤呈现黄色 |
几种短周期元素的原子半径及主要化合价如表:下列叙述错误的是( )
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
| A、R的氧化物对应的水化物可能具有两性 |
| B、X单质在氧气中燃烧不可能生成XO3 |
| C、离子半径大小:r(M3+)>r(T2-) |
| D、L2+和X2-的核外电子数相等 |


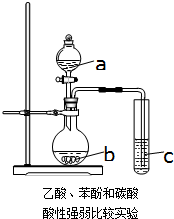 化学研究性学习小组进行验证乙酸、碳酸和苯酚溶液的酸性强弱的探究实验.设计如图一次性完成乙酸、碳酸和苯酚溶液酸性强弱验证的实验装置.
化学研究性学习小组进行验证乙酸、碳酸和苯酚溶液的酸性强弱的探究实验.设计如图一次性完成乙酸、碳酸和苯酚溶液酸性强弱验证的实验装置.