题目内容
15.用铝箔包裹着2.3g金属钠,投入到足量水中,产生的氢气的质量为0.16g,则铝箔的质量为( )| A. | 0.45 g | B. | 0.54 g | C. | 0.5 g | D. | 0.35 g |
分析 2.3gNa的物质的量为$\frac{2.3g}{23g/mol}$=0.1mol,由2 Na+2H2O=2NaOH+H2↑,可知生成NaOH为0.1mol,反应生成氢气总物质的量为$\frac{0.16g}{2g/mol}$=0.08mol,由2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,0.1molNaOH完全反应会生成0.15mol氢气,大于0.08mol,故Al完全反应、NaOH有剩余,根据电子转移守恒计算Al的物质的量,再根据m=nM计算Al的质量.
解答 解:2.3gNa的物质的量为$\frac{2.3g}{23g/mol}$=0.1mol,由2 Na+2H2O=2NaOH+H2↑,可知生成NaOH为0.1mol,反应生成氢气总物质的量为$\frac{0.16g}{2g/mol}$=0.08mol,由2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,0.1molNaOH完全反应会生成0.15mol氢气,大于0.08mol,故Al完全反应、NaOH有剩余,根据电子转移守恒,0.1mol×1+3n(Al)=0.08mol×2,故n(Al)=0.02mol,则铝箔的质量为0.02×27g/mol=0.54g,
故选:B.
点评 本题考查混合物计算、化学方程式计算,关键是判断Al与氢氧化钠溶液反应中氢氧化钠过量,难度中等.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
5.列有关事实及原因的分析中,错误的是( )
| 事实 | 原因 | |
| A | 稀有气体的晶体属于原子晶体 | 其组成微粒是原子 |
| B | 键的极性H-O>H-S | 氧的电负性强于S的电负性 |
| C | HF稳定性比HI强 | HF分子间能形成氢键而HI不能 |
| D | 金刚石的熔沸点高于晶体硅 | C-C键能大于Si-Si键能 |
| A. | A | B. | B | C. | C | D. | D |
3.下列说法一定正确的是( )
| A. | 其水溶液导电的一定是离子晶体 | |
| B. | 固态导电的一定是金属晶体 | |
| C. | 共价化合物形成的晶体一定是分子晶体 | |
| D. | 固态不导电、熔融态导电的一定是离子晶体 |
9.下列各组有机物的鉴别(括号内为鉴别试剂)不合理的是( )
| A. | 苯、甲苯、溴乙烷(酸性高锰酸钾溶液) | B. | 乙醇、乙醛、乙酸(新制Cu(OH)2 | ||
| C. | 苯、乙醇、四氯化碳(水) | D. | 苯、己烷、苯酚溶液(浓溴水) |
10.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.2 NA | |
| B. | 2.24LCO和CO2的混合气体中所含的碳原子数一定是NA | |
| C. | 78g苯含有C=C双键的数目为3NA | |
| D. | 5.6 g铁和6.4 g铜分别与0.1 mol氯气完全反应,转移的电子数相等 |
 .
.
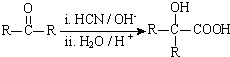 (R、R′代表烃基)
(R、R′代表烃基)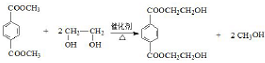 ;
; ;
;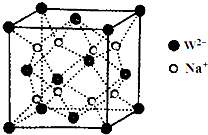 前四周期元素X、Y、Z、W、R、Q的原子序数依次增大,X的核外电子总数与其周期数相同;Y有三个能级,且每个能级上的电子数相等;Z原子单电子数在同周期元素中最多;W与Z同周期,第一电离能比Z的低;R与Y同一主族,Q的最外层电子数为2,其他电子层电子均处于饱和状态.请回答下列问题:
前四周期元素X、Y、Z、W、R、Q的原子序数依次增大,X的核外电子总数与其周期数相同;Y有三个能级,且每个能级上的电子数相等;Z原子单电子数在同周期元素中最多;W与Z同周期,第一电离能比Z的低;R与Y同一主族,Q的最外层电子数为2,其他电子层电子均处于饱和状态.请回答下列问题: