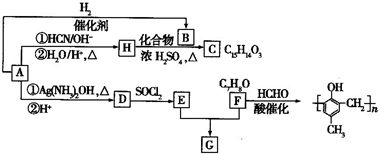
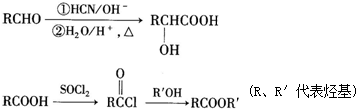
题目内容
黄铜矿是工业炼铜的主要原料,主要成分为CuFeS2,含少量脉石.为测定该黄铜矿的纯度,某同学设计了如下实验:用电子天平称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准碘溶液20.00mL.请回答下列问题:
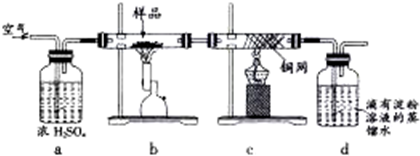
(1)将样品研细后再进行反应,其目的是 ;标准碘溶液应盛放在(填“碱式”或“酸式”) 滴定管中.
(2)装置a的作用是 (填序号).
A.除去空气中的二氧化碳 B.除去空气中的水蒸气
C.有利于气体混合 D.有利于观察、控制空气流速
(3)若去掉c装置,会使测定结果(填“偏低”、“偏高”或“无影响”) ,写出影响测定结果的化学方程式: .
(4)上述反应结束后,仍需通一段时间的空气,其目的是 .
(5)通过计算可知,该黄铜矿的纯度为 .
| 1 |
| 10 |

(1)将样品研细后再进行反应,其目的是
(2)装置a的作用是
A.除去空气中的二氧化碳 B.除去空气中的水蒸气
C.有利于气体混合 D.有利于观察、控制空气流速
(3)若去掉c装置,会使测定结果(填“偏低”、“偏高”或“无影响”)
(4)上述反应结束后,仍需通一段时间的空气,其目的是
(5)通过计算可知,该黄铜矿的纯度为
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)增大固体的表面积可以加快化学反应速率;碘具有氧化性,应放在酸式滴定管中;
(2)浓硫酸可以将水除去,还可以根据冒出气泡的速率来调节空气流速;
(3)去掉c装置气体中二氧化硫在水溶液中会和氧气反应,测定结果偏小;
(4)二氧化硫全部被吸收是实验成败的关键;
(5)二氧化硫和单质碘之间发生氧化还原反应,根据消耗碘单质的量可以确定二氧化硫的量,进而确定黄铜矿的纯度.
(2)浓硫酸可以将水除去,还可以根据冒出气泡的速率来调节空气流速;
(3)去掉c装置气体中二氧化硫在水溶液中会和氧气反应,测定结果偏小;
(4)二氧化硫全部被吸收是实验成败的关键;
(5)二氧化硫和单质碘之间发生氧化还原反应,根据消耗碘单质的量可以确定二氧化硫的量,进而确定黄铜矿的纯度.
解答:
解:该实验原理是:根据黄铜矿受热分解产生的二氧化硫的量的测定(二氧化硫可以用碘水来标定),结合元素守恒可以确定黄铜矿的量,进而计算其纯度.
(1)将样品研细后再反应,即增大固体的表面积,目的是使原料充分反应、加快反应速率;碘具有氧化性,应放在酸式滴定管中;
故答案为:使原料充分反应、加快反应速率;酸式;
(2)装置a中的浓硫酸可易吸收空气中的水蒸气,同时根据冒出的气泡的速率来控制气体的通入量,故答案为:BD;
(3)去掉c装置气体中二氧化硫在水溶液中会和氧气反应,反应的化学方程式为:2SO2+O2+H2O=2H2SO4,测定结果偏小,
故答案为:偏低;2SO2+O2+H2O=2H2SO4;
(4)黄铜矿受热分解生成二氧化硫等一系列产物,分解完毕后仍然通入空气,可以将产生的二氧化硫全部排出去,使结果精确,
故答案为:使反应生成的SO2全部进入d装置中,使结果精确;
(5)根据反应实质,得到:2I2~2SO2~CuFeS2,消耗掉0.05mol/L标准碘溶液20.00mL时,即消耗的碘单质的量为:0.05mol/L×0.02L=0.0010mol,所以黄铜矿的质量是:0.5×0.0010mol×184g/mol×10=0.92g,所以其纯度是:
×100%=80%,故答案为:80%.
(1)将样品研细后再反应,即增大固体的表面积,目的是使原料充分反应、加快反应速率;碘具有氧化性,应放在酸式滴定管中;
故答案为:使原料充分反应、加快反应速率;酸式;
(2)装置a中的浓硫酸可易吸收空气中的水蒸气,同时根据冒出的气泡的速率来控制气体的通入量,故答案为:BD;
(3)去掉c装置气体中二氧化硫在水溶液中会和氧气反应,反应的化学方程式为:2SO2+O2+H2O=2H2SO4,测定结果偏小,
故答案为:偏低;2SO2+O2+H2O=2H2SO4;
(4)黄铜矿受热分解生成二氧化硫等一系列产物,分解完毕后仍然通入空气,可以将产生的二氧化硫全部排出去,使结果精确,
故答案为:使反应生成的SO2全部进入d装置中,使结果精确;
(5)根据反应实质,得到:2I2~2SO2~CuFeS2,消耗掉0.05mol/L标准碘溶液20.00mL时,即消耗的碘单质的量为:0.05mol/L×0.02L=0.0010mol,所以黄铜矿的质量是:0.5×0.0010mol×184g/mol×10=0.92g,所以其纯度是:
| 0.92g |
| 1.15g |
点评:本题是一道关于物质的百分含量的综合考查题目,考查学生分析和解决问题的能力,难度较大.明确反应原理和物质的性质是解题关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式正确的是( )
| A、用醋酸除水垢:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- | ||
B、氯乙酸与氢氧化钠溶液共热:ClCH2COOH+OH-
| ||
C、乙醛与碱性氢氧化铜悬浊液混合后加热至沸腾:CH3CHO+2Cu(OH)2+OH-
| ||
D、服用阿司匹林过量出现水杨酸(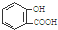 )中毒反应,可静脉注射NaHCO3溶液: )中毒反应,可静脉注射NaHCO3溶液: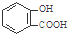 +2 HCO3-→ +2 HCO3-→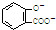 +2 CO2↑+2 H2O +2 CO2↑+2 H2O |
某探究小组利用丙酮的溴代反应(CH3COCH3+Br2
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系.反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定.在一定温度下,获得如下实验数据:
分析实验数据所得出的结论不正确的( )
| HCl |
| 实 验 序 号 | 初始浓度c/mol?L-1 | 溴颜色消失 所需时间t/s | ||
| CH3COCH3 | HCl | Br2 | ||
| ① | 0.80 | 0.20 | 0.0010 | 290 |
| ② | 1.60 | 0.20 | 0.0010 | 145 |
| ③ | 0.80 | 0.40 | 0.0010 | 145 |
| ④ | 0.80 | 0.20 | 0.0020 | 580 |
| A、增大c(Br2),v(Br2)增大 |
| B、实验②和③的v(Br2)相 |
| C、增c(HCl),v(Br2)增大 |
| D、增大c(CH3COCH3),v(Br2)增大 |
由相同条件下的三个反应:①2NaA+B2=2NaB+A2; ②2NaC+A2=2NaA+C2;③2NaB+D2=2NaD+B2;可判断( )
| A、氧化性:A2>B2>C2>D2 |
| B、还原性:C->A->B->D- |
| C、2NaD+A2=2NaA+D2可进行 |
| D、2NaC+B2=2NaB+C2不能进行 |
A、B、C、D、E是同一周期的五种主族元素,A与B的最高氧化物对应的水化物呈碱性,且碱性B>A;C和D的气态氢化物稳定性为C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序为( )
| A、ABCDE |
| B、CDABE |
| C、BADCE |
| D、ECDBA |
下列说法正确的是( )
| A、pH=3的HX酸与pH=11的YOH碱等体积混合,所得溶液的pH一定为7 |
| B、在0.1 mol/L (NH4)2Fe(SO4)2溶液中c(H+)+c(NH4+)+c(Fe2+)=c(OH-)+c(SO42-) |
| C、在醋酸钠溶液中加入适量醋酸,所得酸性溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、0.2 mol/L HCl与0.1 mol/L NaAlO2等体积混合,所得溶液中c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-) |