题目内容
3.有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol•L-1 H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.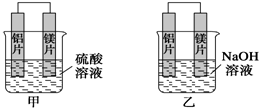
(1)写出甲池中正极的电极反应式:正极:2H++2e-=H2↑.
(2)写出乙池中负极的电极反应式和总反应的离子方程式:负极:2Al+8OH--6e-═2AlO2-+4H2O.总反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出Mg活动性更强,而乙会判断出Al活动性更强(填写元素符号).
(4)由此实验,可得到如下哪些正确结论AD?
A.利用原电池反应判断金属活动顺序时应注意选择合适的电解质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序表已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析.
分析 (1)在酸性介质中镁比铝活泼,所以甲中镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应;
(2)在碱性介质中铝比镁活泼,所以乙池中铝易失电子作负极、镁作正极,负极上铝失电子发生氧化反应;
(3)根据作负极的金属活泼性强结合电池中的负极判断;
(4)A.原电池正负极与电解质溶液有关;
B.镁的金属性大于铝;
C.该实验说明金属活动性顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析;
解答 解:(1)镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应,原电池中阴离子向负极移动,所以硫酸根离子流向镁片,正极的电极反应式为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(2)在碱性介质中铝比镁活泼,所以乙池中铝易失电子作负极、镁作正极,负极上铝失电子发生氧化反应,负极的电极反应式为:2Al+8OH--6e-═2AlO2-+4H2O
,总的电极反应式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+8OH--6e-═2AlO2-+4H2O;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)甲中镁作负极、乙中铝作负极,根据作负极的金属活泼性强判断,甲中镁活动性强、乙中铝活动性强,故答案为:Mg;Al;
(4)A.根据甲、乙中电极反应式知,原电池正负极与电解质溶液有关,故正确;
B.镁的金属性大于铝,但失电子难易程度与电解质溶液有关,故错误;
C.该实验对研究物质的性质有实用价值,故错误;
D.该实验说明化学研究对象复杂,反应与条件有关,电极材料相同其反应条件不同导致其产物不同,所以应具体问题具体分析,故正确;
故答案为:AD.
点评 本题考查金属活泼性及探究原电池原理,为高频考点,明确原电池中各个电极上发生的反应是解本题关键,注意不能根据金属的活动性强弱判断正负极,要根据失电子难易程度确定负极为易错点,题目难度中等.

| A. | 用试管夹从试管底由下往上夹住试管口约$\frac{1}{3}$处,手持试管夹长柄末端,进行加热 | |
| B. | 使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中 | |
| C. | 把玻管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻管插入端,缓慢旋进塞孔中 | |
| D. | 制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中 |
| A. | 溶液中的阳离子向正极移动,阴离子向负极移动 | |
| B. | 电流方向是从锌片经导线流向铜片 | |
| C. | 锌片是正极,铜片上有气泡产生 | |
| D. | 电解液的酸性逐渐增强 |
| 编号 | 电极材料 | 电解质溶液 | 电流指针偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Zn | 浓硝酸 | 偏向Al |
(1)实验1、2中Al所作的电极是否相同?不同.
(2)实验1、4中Al所作的电极是否相同?不同.
(3)写出实验3中的电极反应式.正极:2H++2e-═H2↑;
(4)用电子式表示氯化镁的形成过程:
 .
.  图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:| Date:2015.03.06 实验后的记录: ①Zn为阳极,Cu为阴极 ②H+向负极移动 ③电子流动方向Zn→Cu ④Zn极有H2产生 ⑤若有1mol电子流过导线,则产生H2为0.5mol. ⑥正极的电极反应式:Zn-2e-=Zn2+ |
(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是锌片不纯,在锌片上形成原电池.
(3)如果把锌片换成石墨,发现电流计指针几乎不能偏转,原因Cu和石墨都不与硫酸反应,不会形成原电池.
(4)如果把硫酸换成硫酸铜溶液,猜测铜极(填“锌极”或“铜极”)变粗,原因是Cu2++2e-=Cu(用电极方程式表示).
| A. | 乙烯(C2H4)的电子式: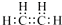 | B. | 丙烯(C3H6)的结构简式:CH2CHCH3 | ||
| C. | 立方烷(C8H8)的键线式: | D. | 溴乙烷(C2H5Br)的比例模型: |
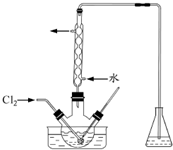 实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下: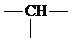 .则它的可能结构有( )
.则它的可能结构有( )