题目内容
下列说法正确的是( )
| A、将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁 |
| B、在原电池装置中,电子从负极流出,沿导线流入正极,经溶液或盐桥回到负极 |
| C、在c(H+)/c(OH-)=l012溶液中 Na+、I-、NO3-、SO42-不能大量共存 |
| D、饱和FeCl3溶液在20℃时呈现棕黄色,100℃呈现红褐色,不能用平衡移动原理来解释 |
考点:原电池和电解池的工作原理,化学平衡的影响因素,离子共存问题
专题:离子反应专题,化学平衡专题,电化学专题
分析:A、将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中一定有铜,可能有铁;
B、溶液中无电子移动;
C、c(H+)/c(OH-)=l012溶液中,pH=1,酸性环境中硝酸根离子能够氧化碘离子;
D、FeCl3溶液在20℃时呈现棕黄色,100℃呈现红褐色,是因为温度升高铁离子水解程度增强导致.
B、溶液中无电子移动;
C、c(H+)/c(OH-)=l012溶液中,pH=1,酸性环境中硝酸根离子能够氧化碘离子;
D、FeCl3溶液在20℃时呈现棕黄色,100℃呈现红褐色,是因为温度升高铁离子水解程度增强导致.
解答:
解:A、将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中不一定有铁,故A错误;
B、溶液中是离子定向移动形成电流,无电子移动,故B错误;
C、c(H+)/c(OH-)=l012溶液中,pH=1,酸性环境中硝酸根离子能够氧化碘离子,故C正确;
D、铁离子水解是吸热反应,升温有利于平衡正向移动,能用平衡移动原理来解释,故D错误;
故选C.
B、溶液中是离子定向移动形成电流,无电子移动,故B错误;
C、c(H+)/c(OH-)=l012溶液中,pH=1,酸性环境中硝酸根离子能够氧化碘离子,故C正确;
D、铁离子水解是吸热反应,升温有利于平衡正向移动,能用平衡移动原理来解释,故D错误;
故选C.
点评:本题考查了金属的置换反应、在溶液中电流产生的原因、离子共存、盐类水解,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列措施对水的电离平衡无影响的是( )
| A、升高温度 |
| B、加入醋酸或氢氧化钠 |
| C、加入氯化铵 |
| D、加入食盐 |
一定条件下,有关金属腐蚀的下列说法不正确的是( )
| A、钢铁制品腐蚀时正极反应:O2+2H2O+4e-=4OH- |
| B、在酸性较强的溶液中,金属主要发生析氢腐蚀 |
| C、为减缓金属腐蚀,可将要保护的金属物件与外电源的正极相连接 |
| D、在海轮外壳上附着一些锌块,则可以减缓海轮外壳的腐蚀 |
下列有关说法不正确的是( )
| A、铝制品比铁制品在空气中更容易被腐蚀 |
| B、实验室用铜片与稀硝酸反应产生的气体可用排水法收集 |
| C、向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同 |
| D、以海水为原料能制取Na、HCl、Mg、Br2等物质 |
下列说法与盐类水解无关的是( )
| A、实验室配制FeCl3溶液时用盐酸溶解FeCl3固体 |
| B、向沸水中滴加饱和FeCl3溶液加热至红褐色制得Fe(OH)3胶体 |
| C、短期保存FeCl2溶液时向其中加入少量铁粉 |
| D、保存Na2CO3溶液的试剂瓶用橡胶塞而不能用玻璃塞 |
常温下,向一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,停止滴加,此时溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液体积之和,则所加入的NaHSO4溶液与Ba(OH)2溶液体积之比是( )
| A、1:4 | B、4:1 |
| C、1:9 | D、9:1 |
根据如图所给信息,得出的结论正确的是( )
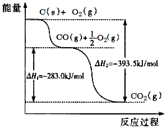

| A、48g碳完全燃烧放出热量为1574 kJ/mol |
| B、2C(s)+O2(g)═2CO(g)△H=-221.0kJ/mol |
| C、2CO2(g)═2CO(g)+O2(g)△H=+283.0kJ/mol |
| D、C(s)+O2(g)═CO2(s)△H=-393.5kJ/mol |
下列说法中正确的是( )
| A、1mol任何纯净物都含有相同的原子数 |
| B、1molO2中约含有6.02×1023个氧分子 |
| C、1mol水中含有8mol电子 |
| D、阿伏加德罗常数就是6.02×1023mol-1 |