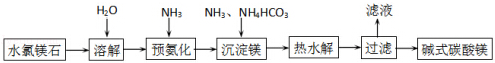
题目内容
13.A、B、C、D四种短周期元素的原子序数依次增大,A元素的气态氢化物与A元素的最高价氧化物对应的水化物能反应生成盐X;B原子核内质子数目与中子数目相等,0.5mol B元素的离子得到6.02×1023个电子被还原为中性原子,0.4g B的氧化物恰好与100ml 0.2mol/L的盐酸完全反应;B和D可组成化合物BD2;C元素的最高正化合价与负化合价代数和为4.回答下列问题:(1)A元素形成的单质的结构式为:N≡N.X中所含阳离子的电子式为
 .
.(2)D的最高价氧化物对应水化物的化学式:HClO4.
(3)用电子式表示B、C形成化合物的过程
 .
.(4)B、D最高价氧化物对应的水化物在溶液中反应的离子方程式为:Mg(OH)2+2H+=Mg2++2H2O
(5)B、C、D三种元素简单离子的离子半径由大到小的顺序是:S2->Cl->Mg2+.(填离子符号)
分析 短周期元素A、B、C、D的原子序数依次增大,A元素的气态氢化物与A元素的最高价氧化物对应的水化物能反应生成盐X,则A为N元素,X为NH4NO3,0.5mol B元素的离子得到6.02×1023个电子被还原为中性原子,则B离子为带两个单位正电荷的阳离子,0.4g B的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,由BO+2HCl═BCl2+H2O,可知BO的物质的量为$\frac{1}{2}$×0.1L×0.2mol/L=0.01mol,则M(BO)=$\frac{0.4g}{0.01mol}$=40g/mol,所以B的摩尔质量为40g/mol-16g/mol=24g/mol,B原子核内质子数目与中子数目相等,则B的质子数为12,则B为Mg元素;C元素的最高正化合价与负化合价代数和为4,处于VIA族,故C为S元素,B和D可组成化合物BD2,则D为Cl.
解答 解:短周期元素A、B、C、D的原子序数依次增大,A元素的气态氢化物与A元素的最高价氧化物对应的水化物能反应生成盐X,则A为N元素,X为NH4NO3,0.5mol B元素的离子得到6.02×1023个电子被还原为中性原子,则B离子为带两个单位正电荷的阳离子,0.4g B的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,由BO+2HCl═BCl2+H2O,可知BO的物质的量为$\frac{1}{2}$×0.1L×0.2mol/L=0.01mol,则M(BO)=$\frac{0.4g}{0.01mol}$=40g/mol,所以B的摩尔质量为40g/mol-16g/mol=24g/mol,B原子核内质子数目与中子数目相等,则B的质子数为12,则B为Mg元素;C元素的最高正化合价与负化合价代数和为4,处于VIA族,故C为S元素,B和D可组成化合物BD2,则D为Cl.
(1)A元素形成的单质为N2,结构式为:N≡N,X为NH4NO3,所含阳离子电子式为 ,
,
故答案为:N≡N; ;
;
(2)D为Cl元素,最高价氧化物对应水化物的化学式为HClO4,
故答案为:HClO4;
(3)B、C形成化合物为MgS,用电子式表示其形成过程为: ,
,
故答案为: ;
;
(4)B、D最高价氧化物对应的水化物在溶液中反应的离子方程式为:Mg(OH)2+2H+=Mg2++2H2O,
故答案为:Mg(OH)2+2H+=Mg2++2H2O;
(5)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:S2->Cl->Mg2+,
故答案为:S2->Cl->Mg2+.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,需要学生熟练掌握元素化合物知识,侧重对化学用语的考查,掌握用电子式表示物质或化学键形成.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案| A. | 盛装浓硫酸的烧杯敞口放置一段时间后质量增加 | |
| B. | 把铜片放入浓硫酸中并加热有气体产生 | |
| C. | 常温下可用铁、铝容器盛装浓硫酸 | |
| D. | 向蔗糖中加入浓硫酸,蔗糖变黑膨胀并有刺激性气味的气体放出 |
| A. | CH3COOH | B. | Cl2 | C. | NH4HCO3 | D. | SO2 |
| A. | 亚硫酸的酸性大于碳酸,故硫的非金属性大于碳 | |
| B. | 碳酸的酸性大于次氯酸,故碳的非金属性大于氯 | |
| C. | 硝酸的酸性大于硅酸,故氮的非金属性大于硅 | |
| D. | 氢氟酸的酸性大于氢氯酸,故氟的非金属性大于氯 |
| A. | 含有离子键和共价键的化合物一定是离子化合物 | |
| B. | 11H2O、12H2O、13H2O互为同位素 | |
| C. | 目前人们已发现的元素种类数目与原子种类数目相同 | |
| D. | 1H的质量数为1,所以氢元素的相对原子质量近似为1 |