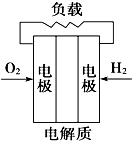
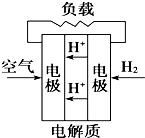
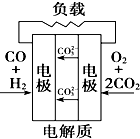
题目内容
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.已知:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H1=-443.64kJ?mol-12CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ?mol-1下列说法或热化学方程式正确的是( )
| A、CO的燃烧热为566.0 kJ?mol-1 |
| B、2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 |
| C、完全燃烧20g甲醇,生成二氧化碳和水蒸气时放出的热量为908.3 kJ |
| D、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1453.28 kJ?mol-1 |
考点:有关反应热的计算,用盖斯定律进行有关反应热的计算
专题:
分析:A.1mol可燃物完全燃烧生成稳定氧化物放出的热量为燃烧热;
B.放热反应中反应物的总能量大于生成物的总能量;
C.根据盖斯定律计算;
D.方程式的计量数加倍,则反应热也加倍.
B.放热反应中反应物的总能量大于生成物的总能量;
C.根据盖斯定律计算;
D.方程式的计量数加倍,则反应热也加倍.
解答:
解:A.1mol可燃物完全燃烧生成稳定氧化物放出的热量为燃烧热,2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ?mol-1,则CO的燃烧热为283.0 kJ?mol-1,故A错误;
B.放热反应中反应物的总能量大于生成物的总能量,所以2 mol CO和1 mol O2的总能量比2 mol CO2的总能量高,故B错误;
C.已知:①CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H1=-443.64kJ?mol-1 ②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ?mol-1根据盖斯定律①+②×
得CH3OH(l)+
O2(g)=CO2(g)+2H2O(g)△H1=-726.64kJ?mol-1 ,则完全燃烧20g甲醇,即0.625mol,则放出的热量为0.625mol×726.64kJ?mol-1 =454.15 kJ,故C错误;
D.由C项知CH3OH(l)+
O2(g)=CO2(g)+2H2O(g)△H1=-726.64kJ?mol-1 ,方程式的计量数加倍,则反应热也加倍则2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1453.28 kJ?mol-1,故D正确;
故选D.
B.放热反应中反应物的总能量大于生成物的总能量,所以2 mol CO和1 mol O2的总能量比2 mol CO2的总能量高,故B错误;
C.已知:①CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H1=-443.64kJ?mol-1 ②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ?mol-1根据盖斯定律①+②×
| 1 |
| 2 |
| 3 |
| 2 |
D.由C项知CH3OH(l)+
| 3 |
| 2 |
故选D.
点评:本题考查了反应热的计算、盖斯定律的应用、热化学方程式的书写等,题目难度不大,注意把握盖斯定律的含义.

练习册系列答案
相关题目
下列反应中属于氧化还原反应,但水没有发生氧化还原反应的是( )
| A、Cl2+H2O=HCl+HClO |
| B、2F2+2H2O=4HF+O2 |
| C、Na2O+H2O=2NaOH |
| D、2Na+H2O=2NaOH+H2 |
已知M、W、X、Y、Z为短周期元素,M为形成化合物最多的元素,W、Z同主族,X、Y、Z同周期,Z元素的原子序数为W的2倍,Z的最外层电子数为Y的最外层电子数的2倍,Y的电子层数和最外层电子数相等,W和X能形成X2W和X2W2两种常见化合物,下列说法错误的是( )
| A、W、X、Y形成的简单离子半径大小关系为W>X>Y |
| B、M、W元素形成的简单氢化物的沸点:W>M |
| C、X金属元素是同周期中金属性最强的元素 |
| D、Z的最高价氧化物对应的水化物的浓溶液能与Y在常温下剧烈反应 |
下列化合物中同分异构体数目最少的是( )
| A、己烷 | B、戊醇 |
| C、戊烯 | D、乙酸乙酯 |
下列各组物质的稀溶液相互反应,把前者逐滴滴入后者与把后者逐滴滴入前者,所产生的现象相同的是( )
| A、AlCl3 和NaOH |
| B、Na2CO3和HCl |
| C、NaHCO3和HCl |
| D、NaAlO2和HCl |
混合气体由N2和CH4组成,测得混合气体在标准状况下的密度为0.821g/L,则混合气体中N2和CH4的体积之比为( )
| A、5:1 | B、1:4 |
| C、4:1 | D、1:5 |